摘要:28. 在点燃氢气等可燃性气体之前必须检验 .纯净的氢气在空气中可以平静地燃烧.形成 的火焰.
网址:http://m.1010jiajiao.com/timu3_id_3960150[举报]
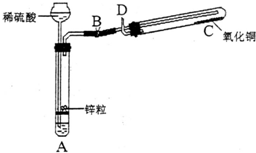 某学生用如图所示装置制备氢气,并用制得的氢气还原氧化铜(装置中必要的铁架台、铁夹、加热设备等在图中均已略去).请填写下列空白:
某学生用如图所示装置制备氢气,并用制得的氢气还原氧化铜(装置中必要的铁架台、铁夹、加热设备等在图中均已略去).请填写下列空白:(1)实验时,打开B处止水夹,在试管A中,除了液面上升以外,用眼睛还可以观察到的现象是
有气泡冒出
有气泡冒出
,过一段时间后,用手触摸试管A的外壁可以感觉到的现象是发热
发热
,试管A中发生反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑
Zn+H2SO4═ZnSO4+H2↑
,其反应类型为置换反应
置换反应
.(2)在做氢气还原氧化铜实验之前,必须在D出口处
检验氢气的纯度
检验氢气的纯度
,然后在C
C
处点燃酒精灯加热;实验过程中,在试管C中可以观察到的现象是黑色氧化铜变为红色,有无色液体生成
黑色氧化铜变为红色,有无色液体生成
;发生反应的化学方程式为H2+CuO
Cu+H2O
| ||
H2+CuO
Cu+H2O
;实验结束时,
| ||
后
后
关闭B处止水夹,先
先
停止加热(填“先”或“后”).(3)实验过程中,该同学若想证明氢气具有可燃性,其实验操作是
点燃出口D处的氢气
点燃出口D处的氢气
.下列关于化学实验基本操作的叙述错误的是( )
查看习题详情和答案>>
| A.制取气体时应先检查装置的气密性 |
| B.点燃可燃性气体之前必须检验气体的纯度 |
| C.称取一定质量的氢氧化钠等腐蚀性固体药品可放在表面皿等玻璃器皿中称量 |
| D.取用固体药品,只可用镊子夹取 |
化学与生产、生活密切相关.
(1)人类生活离不开空气.北京市政府为防止空气污染采取措施,要求各单位用煤必须使用低硫优质煤,这种做法能有效减少排放的气体是
(2)在生活中,缓慢氧化的例子很多,以下属于缓慢氧化的有(填序号)
①蜡烛燃烧,②动植物的呼吸,③食物的腐烂,④酒和醋的酿造,⑤火药爆炸,⑥钢铁生锈,⑦农家肥料的腐熟.
(3)硅是信息技术的关键材料,高温下氢气与四氯化硅(SiCl4)反应可制得高纯度的硅,同时生成氯化氢.该反应的化学方程式为
(4)录像用的高性能磁粉,主要材料之一是由三种元素组成的化学式为CoxFe(3-x)O(3-x)的化合物,已知氧为-2价,钴(Co)和铁可能呈现+2价或+3价,且上述化合物中,每种元素只有一种化合价.则x值为
(5)肾病患者需要食用低钠盐的食品.目前,市场供应的低钠盐多为苹果酸钠盐(C4H5O5Na).每日食用5g苹果酸钠盐,人体摄入的钠元素质量仅为等质量食盐中钠元素质量的
A.18.7% B.26.7% C.37.5% D.43.1%
查看习题详情和答案>>
(1)人类生活离不开空气.北京市政府为防止空气污染采取措施,要求各单位用煤必须使用低硫优质煤,这种做法能有效减少排放的气体是
二氧化硫
二氧化硫
;燃煤过程中,生成该气体的化学方程式为S+O2
SO2
| ||
S+O2
SO2
.
| ||
(2)在生活中,缓慢氧化的例子很多,以下属于缓慢氧化的有(填序号)
②③④⑥⑦
②③④⑥⑦
.①蜡烛燃烧,②动植物的呼吸,③食物的腐烂,④酒和醋的酿造,⑤火药爆炸,⑥钢铁生锈,⑦农家肥料的腐熟.
(3)硅是信息技术的关键材料,高温下氢气与四氯化硅(SiCl4)反应可制得高纯度的硅,同时生成氯化氢.该反应的化学方程式为
2H2+SiCl4
Si+4HCl
| ||
2H2+SiCl4
Si+4HCl
.
| ||
(4)录像用的高性能磁粉,主要材料之一是由三种元素组成的化学式为CoxFe(3-x)O(3-x)的化合物,已知氧为-2价,钴(Co)和铁可能呈现+2价或+3价,且上述化合物中,每种元素只有一种化合价.则x值为
1
1
,铁的化合价为+3
+3
.(5)肾病患者需要食用低钠盐的食品.目前,市场供应的低钠盐多为苹果酸钠盐(C4H5O5Na).每日食用5g苹果酸钠盐,人体摄入的钠元素质量仅为等质量食盐中钠元素质量的
C
C
.A.18.7% B.26.7% C.37.5% D.43.1%
氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂.
【资料在线】
Ⅰ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生一种气体.
Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气.
Ⅲ.用氢气与金属钙加热的方法可制得氢化钙.
Ⅳ.白色的无水硫酸铜粉末吸水后会变蓝.
探究一:定性分析
(1)对于“金属钙与水反应生成的气体”有如下猜想:甲.氧气,乙.氢气你支持
(2)CaH2中氢元素的化合价是
(3)登山运动员常携带氢化钙作为能源提供剂,与携带氢气相比,其优点是
(4)用氢气与金属钙加热可得到氢化钙,以下是反应装置图.
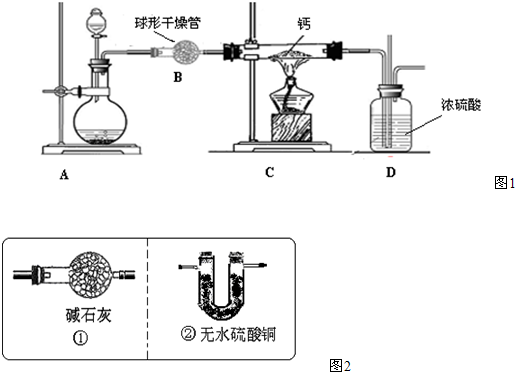
装置A 中装有锌粒和稀硫酸,请写出其反应的化学方程式
(5)制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,在溶液中滴入酚酞后显红色.该同学据此判断:上述实验确有CaH2生成.你认为是否正确
探究二:产物定量测定
测定原理:根据金属钙、氢化钙都能与水反应生成气体的原理,采用测定气体的体积的方法.
(1)取氢化钙样品与水反应,利用图1装置测定生成的气体体积时,在
A.气泡连续均匀时
B.刚开始有气泡时
(2)利用该装置,测得的气体体积总是会偏小,同学讨论后采用图2装置测定气体体积.该装置的优点是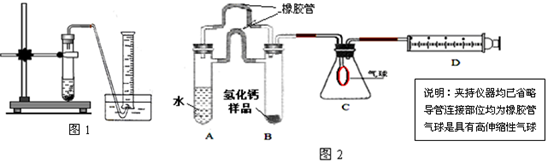
(3)称取46mg 所制得的氢化钙样品,注射器D开始时活塞停留在10mL刻度处,反应结束后充分冷却,活塞最终停留57.04mL刻度处.试通过计算求出样品中氢化钙的纯度(即氢化钙在样品中的质量分数)是
反思提高:
(1)上述实验在学校的实验室内,通过托盘天平等称量工具
(2)测量小组利用电子天平,采用如下图所示方法以反应前后失去的质量来求算纯度,结果纯度的测定值偏
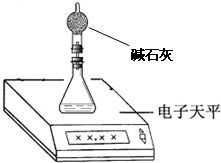
查看习题详情和答案>>
【资料在线】
Ⅰ.金属钙的活动性很强,遇水即刻剧烈反应生成氢氧化钙,同时产生一种气体.
Ⅱ.氢化钙要密封保存,一旦接触到水就发生反应,放出氢气.
Ⅲ.用氢气与金属钙加热的方法可制得氢化钙.
Ⅳ.白色的无水硫酸铜粉末吸水后会变蓝.
探究一:定性分析
(1)对于“金属钙与水反应生成的气体”有如下猜想:甲.氧气,乙.氢气你支持
乙
乙
(填“甲”、“乙”)观点,理由是钙与水反应若生成氧气,反应前后氢氧原子个数比不守恒(反应前氢氧原子个数比为2/1,反应后会大于2/1)
钙与水反应若生成氧气,反应前后氢氧原子个数比不守恒(反应前氢氧原子个数比为2/1,反应后会大于2/1)
.(2)CaH2中氢元素的化合价是
-1
-1
,写出CaH2与水反应的化学方程式CaH2+2H2O═Ca(OH)2+2H2↑
CaH2+2H2O═Ca(OH)2+2H2↑
;(3)登山运动员常携带氢化钙作为能源提供剂,与携带氢气相比,其优点是
固体燃料携带方便,且水是登山运动员必须携带物质,有水就能提供出高能量的氢能
固体燃料携带方便,且水是登山运动员必须携带物质,有水就能提供出高能量的氢能
;(4)用氢气与金属钙加热可得到氢化钙,以下是反应装置图.

装置A 中装有锌粒和稀硫酸,请写出其反应的化学方程式
Zn+H2SO4═ZnSO4+H2↑;
Zn+H2SO4═ZnSO4+H2↑;
,装置B 中装有无水氯化钙,其作用是除去氢气中混有的水蒸气
除去氢气中混有的水蒸气
,若要证明进入C 装置中的氢气已经干燥,在B、C之间应连接下图中的哪个装置:②
②
(填①或②),现象是无水硫酸铜不变色
无水硫酸铜不变色
.(5)制备CaH2实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,在溶液中滴入酚酞后显红色.该同学据此判断:上述实验确有CaH2生成.你认为是否正确
否
否
(填“是”或“否”);原因是因为Ca+2H2O═Ca(OH)2+H2↑也能呈现相同的现象
因为Ca+2H2O═Ca(OH)2+H2↑也能呈现相同的现象
.探究二:产物定量测定
测定原理:根据金属钙、氢化钙都能与水反应生成气体的原理,采用测定气体的体积的方法.
(1)取氢化钙样品与水反应,利用图1装置测定生成的气体体积时,在
B
B
即进行收集(填字母).A.气泡连续均匀时
B.刚开始有气泡时
(2)利用该装置,测得的气体体积总是会偏小,同学讨论后采用图2装置测定气体体积.该装置的优点是
①排除了“因液体加入引起气体排出导致的气体体积测定误差”的可能;②避免了实验操作时,无论塞紧橡皮塞的动作多快,都会有气体逸散的可能;③胶皮管能使两支管内中气体压强保持平衡,便于管A中液体顺利流入管B;④评价气球:气球膨胀过程还可以在一定程度上缓冲一下压强,以防氢气直接快速进入注射器,造成活塞脱落,导致实验失败
①排除了“因液体加入引起气体排出导致的气体体积测定误差”的可能;②避免了实验操作时,无论塞紧橡皮塞的动作多快,都会有气体逸散的可能;③胶皮管能使两支管内中气体压强保持平衡,便于管A中液体顺利流入管B;④评价气球:气球膨胀过程还可以在一定程度上缓冲一下压强,以防氢气直接快速进入注射器,造成活塞脱落,导致实验失败
,如何实现A中的水与B中样品接触而发生反应因为AB管连接处均有胶皮管连接,所以慢慢倾斜A管,直至液体流入B
因为AB管连接处均有胶皮管连接,所以慢慢倾斜A管,直至液体流入B
.
(3)称取46mg 所制得的氢化钙样品,注射器D开始时活塞停留在10mL刻度处,反应结束后充分冷却,活塞最终停留57.04mL刻度处.试通过计算求出样品中氢化钙的纯度(即氢化钙在样品中的质量分数)是
91.30%
91.30%
.(设该条件下每11.2mL氢气的质量为1mg)反思提高:
(1)上述实验在学校的实验室内,通过托盘天平等称量工具
不能
不能
(填“能”、“不能”)完成.(2)测量小组利用电子天平,采用如下图所示方法以反应前后失去的质量来求算纯度,结果纯度的测定值偏
偏低
偏低
.