网址:http://m.1010jiajiao.com/timu3_id_395998[举报]
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O![]() 、C2O
、C2O![]() ,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:

(1)图中曲线1表示________的分布系数变化;曲线3表示________的分布系数变化.
现有物质的量浓度均为0.1 mol/L的下列溶液:
①Na2C2O4
②NaHC2O4
③H2C2O4
④(NH4)2C2O4
⑤NH4HC2O4
已知NaHC2O4溶液显酸性.
(2)Na2C2O4溶液中,c(Na+)/c(C2O![]() )________2(填“>”、“=”、“<”),原因是________(用离子方程式表示).
)________2(填“>”、“=”、“<”),原因是________(用离子方程式表示).
(3)常温下,向10 mL 0.1 mol/L H2C2O4溶液中滴加0.1 mol/L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O![]() )+c(HC2O
)+c(HC2O![]() )时,溶液显________性(填“酸”、“碱”或“中”),且V(NaOH)________10 mL(填“>”、“=”或“<”).
)时,溶液显________性(填“酸”、“碱”或“中”),且V(NaOH)________10 mL(填“>”、“=”或“<”).
(4)下列关于五种溶液的说法中,正确的是
A.
溶液②中,c(C2OB.
溶液②中,c(H2C2O4)+c(OH-)=c(C2OC.溶液④⑤中都符合c(NH![]() )+c(H+)=c(HC2O
)+c(H+)=c(HC2O![]() )+2c(C2O
)+2c(C2O![]() )+c(OH-)
)+c(OH-)
D.五种溶液都符合c(H2C2O4)+c(HC2O![]() )+c(C2O
)+c(C2O![]() )=0.1 mol·L-1.
)=0.1 mol·L-1.
(5)五种溶液中c(H2C2O4)
由大到小排列的顺序是________.(6)
配平氧化还原反应方程式:![]()
(7)
称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液.量取两份此溶液各25 mL,分别置于两个锥形瓶中.第一份溶液中加入2滴酚酞试液,滴加0.25 mol/L NaOH溶液至20 mL时,溶液由无色变为浅红色.第二份溶液用0.10 mol/L酸性KMnO4溶液滴定,滴定终点如何判断________.当加入16 mL 0.10 mol/L酸性KMnO4溶液时恰好反应完全.则原试样中H2C2O4·2H2O的质量分数为________,KHC2O4的质量分数为________.如果用0.25 mol/L NaOH溶液滴定第一份溶液的实验滴定终点仰视读数则测得的KHC2O4的质量分数________(填“偏高”“偏低”或“无影响”)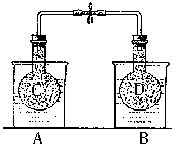 NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把烧瓶C放人A烧杯中,烧瓶D放人B烧杯中。
NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把烧瓶C放人A烧杯中,烧瓶D放人B烧杯中。往A烧杯中加入50.0gNH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0gNaOH固体搅拌使其溶解。回答下列问题:
(1)烧杯A中温度(填“升高”、“降低”或“不变”)_______;烧杯B中温度(填“升高”、“降低”或“不变”)_______。
(2)已知在NO2生成N2O4的可逆反应里,正反应是放热反应,逆反应是吸热反应:
2NO2(g)
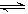 N2O4(g)
N2O4(g)从上面实验可知烧瓶C内混合气体的颜色(填“变浅”、“变深”或“不变”)______;D烧瓶内混合气体的颜色(填“变浅”、“变深”或“不变”)________。
(3)用pH试纸测定烧杯A中溶液的pH可知其pH(填“大于7”、“等于7”或“小于7”)_________,导致该溶液pH这一变化的原因可用离子方程式表示如下:____________。
(4)若实验测得B烧杯中酸碱中和反应放热1.4325kJ,则NaOH溶液和HCl溶液发生中和反应的热化学方程式为________________________________。
(5)若起始时在D烧瓶中充人mgN2O4,此时测得烧瓶中的压强为1.01×105Pa,当可逆反应:N2O4(g)
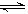 2NO2(g)达到化学平衡状态时压强变为1.515×105Pa,则平衡混合气体的平均相对分子质量为___________(精确到小数点后两位)。
查看习题详情和答案>>
2NO2(g)达到化学平衡状态时压强变为1.515×105Pa,则平衡混合气体的平均相对分子质量为___________(精确到小数点后两位)。
查看习题详情和答案>>
(1)化学是一门以实验为基础的学科,化学实验是化学学习的重要内容.根据你掌握的知识判断,下列实验操作的描述中正确的是______.(填写下列各项序号)
A.任何从试剂瓶中取出的药品,若有剩余均不能再放回原试剂瓶
B.用稀盐酸洗涤盛放过石灰水的试剂瓶
C.配制H2SO4溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
D.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
E.Na2CO3溶液不能保存在带有磨口玻璃塞的试剂瓶中
F.将用水润湿的PH试纸浸入稀盐酸中,测定溶液的PH
(2)据报道,目前一些地区酸雨、灰霾和光化学烟雾等区域性大气污染突出,严重威胁群众健康,影响环境安全.二氧化硫和氮的氧化物是大气的主要污染物,关注臭氧层、防止和治理环境污染是当前环保工作的重要研究内容之一.
①汽车尾气主要含有CO2、CO、SO2、NO及汽油、柴油等到物质,这种尾气越来越成为城市空气污染的主要来源,汽车尾气中的CO来自______,NO来自(用方程式表示)______.
②空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应.下列有关说法正确的是______.
A.停止使用氟里昂是为了保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾一淀粉试纸变蓝
③在一定条件下用氨可将氮氧化物转化为无毒气体.同温同压下,7L NH3恰好将6L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积比是______.
查看习题详情和答案>>
某研究性学习小组为探究在相同条件下,同浓度同体积的一元强酸和弱酸分别与同种金属反应时生成氢气的速率是否相同,组装了两套如下图所示的简易实验装置.该装置同时还可测定该温度和压强下的气体摩尔体积.

该实验的主要操作步骤如下∶
①配制浓度均为1 mol·L-1的盐酸和醋酸溶液;
②在广口瓶乙中装水,按图示连接好装置,检查装置的气密性;
③量取10.0 mL 1 mol·L-1的盐酸和醋酸溶液分别加入两套装置的锥形瓶中;
④称取两份质量均为a g的镁带(除去表面氧化膜、表面积相同),并固定于塑料杆末端;
⑤同时将塑料杆向下移动,使镁带浸入酸中至反应完全,记录反应的起止时间.
⑥反应结束后待温度恢复到室温,读出量筒中水的体积为V mL.
请根据上述步骤回答下列问题∶
(1)步骤④中,理论上称取的镁带质量不能少于________g.
(2)若水蒸气的挥发影响忽略不计,在该温度和压强下,气体摩尔体积为________L·mol-1.
(3)实验过程中观察到的主要现象是∶盛________(填“盐酸”或“醋酸”)的锥形瓶中反应更剧烈,反应完全用时较少;与足量镁带反应完全最终排出水的体积________(填序号字母).
A.盐酸更多
B.醋酸更多
C.一样多
(4)如果将上述实验改为∶在体积均为1 L,pH都等于2的盐酸和醋酸溶液中,分别投入0.65 g锌粒,则下图所示比较符合客观事实的是________(填序号字母).

(11分)(1)化学是一门以实验为基础的学科,化学实验是化学学习的重要内容。根
据你掌握的知识判断,下列实验操作的描述中正确的是 。
(填写下列各项序号)
A.任何从试剂瓶中取出的药品,若有剩余均不能再放回原试剂瓶
B.用稀盐酸洗涤盛放过石灰水的试剂瓶
C.配制H2SO4溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
D.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
E.Na2CO3溶液不能保存在带有磨口玻璃塞的试剂瓶中
F.将用水润湿的PH试纸浸入稀盐酸中,测定溶液的PH
(2)据报道,目前一些地区酸 雨、灰霾和光化学烟雾等区域性大气污染突出,严重威胁
雨、灰霾和光化学烟雾等区域性大气污染突出,严重威胁
群众健康,影响环境安全。二氧化硫和氮的氧化物是大气的主要污染物,关注臭氧层、
防止和治理环境污染是当前环保工作的重要研究内容之一。
①汽 车尾气主要含有CO2、CO、SO2、NO及汽油、柴油等到物质,这种尾气越来越成
车尾气主要含有CO2、CO、SO2、NO及汽油、柴油等到物质,这种尾气越来越成
为城市空气污染的主要来源,汽车尾气中的CO来自  ,
,
NO来自(用方程式表示) 。
②空气中微量的臭氧对人有益,浓度过大则是一种污染气 体,臭氧作为强氧化剂,几乎
体,臭氧作为强氧化剂,几乎
能与任何生物组织反应。下列有关说法正确的是 。
A.停止使用氟里昂是为了保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾一淀粉试纸变蓝
③在一定条件下用氨可将氮氧化物转化为 无毒气体。同温同压下,7LNH3恰好将6LNO
无毒气体。同温同压下,7LNH3恰好将6LNO
和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积比是 。