网址:http://m.1010jiajiao.com/timu3_id_3959670[举报]
甲、乙、丙、丁均为中学常见物质,且甲、乙、丙均含有同一种元素.一定条件下四种物质之间有如图甲所示的转化关系.请回答问题:
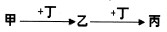
(1)若甲、丁分别为铁和氯气中的一种,则丙的酸性溶液露置于空气中将变质.变质过程所发生反应的离子方程式为______.
(2)已知乙、丁均为空气中含量最多的两种单质,且由甲、丁和NaOH溶液构成的新型燃料电池放电时甲与丁作用转化为乙(同时生成一种对生命活动有重要意义的物质),负极反应式为______.
(3)图示转化关系对应的反应既可以是非氧化还原反应,也可以是氧化还原反应.
①若丁为盐酸且反应均为非氧化还原反应,则甲的水溶液的pH比丙的水溶液的pH______(填“大”或“小”).
②若丁为单质,下列关于物质乙、丙所含的同一元素的价态的推断,正确的是______.
a、乙一定更高 b、丙一定更高 c、乙和丙一样高 d、无法确定
(4)高温下,利用天然气生产合成气的过程涉及上述图示转化关系(生成的H2未标出),且丙能使石灰水变浑浊、“甲→乙”对应的反应为:CH4+H2O-CO+H2(未配平,条件略).
①当1mol甲与丁反应转化为乙时吸收206.1kJ的热量,1mol乙与丁反应转化为丙时放出41.2kJ的热量.则甲与丁直接转化为乙的热化学方程式为______(丁均为气态).
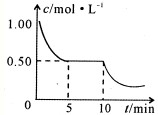
②将甲与丁混合于容积不变密闭容器中,甲将转化为乙,且反应过程中甲浓度变化情况如图所示.试推测:反应10min时,改变的外界条件可能是______.

③t℃时,乙转化为丙反应化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中乙、丁、丙和氢气的物质的量依次为0.5mol、8.5mol、2.0mol和2.0mol.此时反应正、逆反应速率的关系式是______(填代号).
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) D.无法判断.
查看习题详情和答案>>
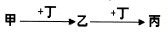
(1)若甲、丁分别为铁和氯气中的一种,则丙的酸性溶液露置于空气中将变质.变质过程所发生反应的离子方程式为
(2)已知乙、丁均为空气中含量最多的两种单质,且由甲、丁和NaOH溶液构成的新型燃料电池放电时甲与丁作用转化为乙(同时生成一种对生命活动有重要意义的物质),负极反应式为
(3)图示转化关系对应的反应既可以是非氧化还原反应,也可以是氧化还原反应.
①若丁为盐酸且反应均为非氧化还原反应,则甲的水溶液的pH比丙的水溶液的pH
②若丁为单质,下列关于物质乙、丙所含的同一元素的价态的推断,正确的是
a、乙一定更高 b、丙一定更高 c、乙和丙一样高 d、无法确定
(4)高温下,利用天然气生产合成气的过程涉及上述图示转化关系(生成的H2未标出),且丙能使石灰水变浑浊、“甲→乙”对应的反应为:CH4+H2O-CO+H2(未配平,条件略).
①当1mol甲与丁反应转化为乙时吸收206.1kJ的热量,1mol乙与丁反应转化为丙时放出41.2kJ的热量.则甲与丁直接转化为乙的热化学方程式为
②将甲与丁混合于容积不变密闭容器中,甲将转化为乙,且反应过程中甲浓度变化情况如图所示.试推测:反应10min时,改变的外界条件可能是
③t℃时,乙转化为丙反应化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中乙、丁、丙和氢气的物质的量依次为0.5mol、8.5mol、2.0mol和2.0mol.此时反应正、逆反应速率的关系式是
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) D.无法判断.
(1)氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为__________________,多余的氯气可用绿矾吸收,反应的离子方程式为____________________________________________________________________。
(2)氯气用于自来水消毒除有异味外,近来发现能产生500多种有致癌、致畸作用的有机氯衍生物,如CHCl3、CCl2Br2等。写出CH4与Cl2反应生成CHCl3的化学方程式:
__________________;__________________;__________________。
以上反应均属于_________反应(填有机反应类型),由此可知,每生成1 mol CHCl3,消耗Cl2的物质的量_________ (填“大于”“等于”或“小于”)3 mol。
(3)用高铁酸钠(Na2FeO4)对来自河、湖的淡水消毒是城市饮用水处理新技术,下列对Na2FeO4能用于饮用水消毒和净化处理的原因分析正确的是( )
A.Na2FeO4在溶液中显强碱性,能消毒杀菌
B.Na2FeO4的还原产物是Fe3+,易水解生成Fe(OH)3,可使水中悬浮物凝聚沉降
C.Na2FeO4的还原产物是Fe2+,易水解为Fe(OH)2,可使水中悬浮物凝聚?沉降
D.Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
高铁(Ⅵ)酸盐是新一代水处理剂,其制备方法有次氯酸盐氧化法(湿法):该法是在碱性溶液中,利用次氯酸盐氧化三价铁盐,试写出并配平这一离子反应方程式:__________________。
(4)我国南方某些地区的井水取来久置后,由澄清透明变成有少量棕红色絮状沉淀沉积于缸底,水面浮着一层“锈皮”,当地居民常采用加明矾的方法处理。①井水久置后,水面浮着的一层“锈皮”的主要成分是_________(写化学式)。②用化学方法鉴别该井水的步骤是__________________;离子方程式是__________________。③用化学方法鉴别经明矾处理后的水的步骤是__________________;离子方程式是__________________。④AlCl3·6H2O(代号AC)和[Al2(OH)nCl6-n]m(代号BAC)都可以作为水澄清剂。它们对水的pH改变的影响是否一样大?_________;原因是什么?__________________。
(5)X物质也可用于自来水消毒,既能提高消毒效率,又安全、无异味、无副作用,该物质在自然界中存在,对地球生物起保护伞作用。X的化学式是_________。X能使湿润的淀粉碘化钾试纸变蓝,试写出该反应的化学方程式:__________________。该反应过程中氧化产物和还原产物的物质的量之比为_________。
(6)ClO2被称为“第四代”饮用水杀菌剂,因其高效、无污染而被广泛使用。我国北京永利科技有限公司已用电解法批量生产ClO2。其反应原理为![]() +4 H+
+4 H+![]() 4ClO2↑+O2↑+2H2O,从反应原理看,应在酸性条件下进行,能否用盐酸调节溶液的酸性?
4ClO2↑+O2↑+2H2O,从反应原理看,应在酸性条件下进行,能否用盐酸调节溶液的酸性?
答:________(填“能”或“不能”),理由是________________________________。
查看习题详情和答案>>