网址:http://m.1010jiajiao.com/timu3_id_3959569[举报]

(2)取用任意体积的该葡萄糖溶液时,下列物理量中不随所取体积的多少而变化的是_________。
A、溶液中C6H12O6的物质的量
B、溶液的质量分数
C、溶液中C6H12O6的物质的量浓度
D、溶液的密度
(3)某学生欲用葡萄糖和蒸馏水配制标签上显示的注射液1000ml,回答下列问题:
①该学生需要称取_________g葡萄糖粉末进行配制。
②请写出该实验的实验步骤:计算,_________,溶解,_________,洗涤,_________,摇匀。在溶解中为了溶解得更快,通常可以采取的措施是__________________。
③所需主要仪器之一为:容量瓶(规格:_________),使用时的第一步操作是_________。
④在配制过程中,下列实验操作对所配制的溶液的物质的量浓度有何影响?
(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
I、称量粉末时物体和砝码位置放反了_________
II、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水_________
Ⅲ、若容量瓶带有少量蒸馏水_________
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用两种方法制备甲醇:
反应Ⅰ:CO(g) + 2H2
(g)  CH3OH (g) DH1
CH3OH (g) DH1
反应Ⅱ:CO2(g) + 3H2(g)  CH3OH (g)+H2O(g)
DH2
CH3OH (g)+H2O(g)
DH2
① 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
由表中数据判断DH1_______________0(填“<”、“=”或“>”)。
② 某温度下,将2molCO和6molH2充入2L密闭容器中充分反应,4分钟后反应达到平衡,测得CO的物质的量为0.4mol,则CO的反应速率为________________,此时的压强是反应前压强的___________倍。
(2)反应Ⅱ的平衡常数表达式为____________________,为了加快反应Ⅱ的反应速率,并且提高H2的转化率,采取的措施是_______________(填写正确选项的字母)。
a.增大CO2的浓度 b.增大H2的浓度
c.增大压强 d.加入催化剂
(3)工业上利用CO与水蒸气的反应,将有毒的CO转化为无毒的CO2,书写有关热化学反应方程式__________________________________。该反应在830K下进行时,初始浓度到达平衡的时间有如下的关系:
|
CO的初始浓度(mol/L) |
2 |
4 |
1 |
3 |
|
H2的初始浓度(mol/L) |
3 |
2 |
3 |
3 |
|
时间(min) |
8 |
6 |
12 |
n |
则n 为________min。
(4)近年来,科研人员新开发出一种甲醇和氧气以强碱溶液为电解质溶液的新型手机电池。该电池中甲醇发生反应的一极为______极、其电极反应式为_________________。
(5)用该电池作电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为 L。
查看习题详情和答案>>
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用两种方法制备甲醇:
反应Ⅰ:CO(g) + 2H2 (g)  CH3OH (g) DH1
CH3OH (g) DH1
反应Ⅱ:CO2(g)+ 3H2(g)  CH3OH (g)+H2O(g) DH2
CH3OH (g)+H2O(g) DH2
① 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
② 某温度下,将2molCO和6molH2充入2L密闭容器中充分反应,4分钟后反应达到平衡,测得CO的物质的量为0.4mol,则CO的反应速率为________________,此时的压强是反应前压强的___________倍。
(2)反应Ⅱ的平衡常数表达式为____________________,为了加快反应Ⅱ的反应速率,并且提高H2的转化率,采取的措施是_______________(填写正确选项的字母)。
a.增大CO2的浓度 b.增大H2的浓度
c.增大压强 d.加入催化剂
(3)工业上利用CO与水蒸气的反应,将有毒的CO转化为无毒的CO2,书写有关热化学反应方程式__________________________________。该反应在830K下进行时,初始浓度到达平衡的时间有如下的关系:
| CO的初始浓度(mol/L) | 2 | 4 | 1 | 3 |
| H2的初始浓度(mol/L) | 3 | 2 | 3 | 3 |
| 时间(min) | 8 | 6 | 12 | n |
则n 为________min。
(4)近年来,科研人员新开发出一种甲醇和氧气以强碱溶液为电解质溶液的新型手机电池。该电池中甲醇发生反应的一极为______极、其电极反应式为_________________。
(5)用该电池作电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为 L。 查看习题详情和答案>>
(1)以N2和H2为原料合成氨气。已知:N2(g)+3H2(g)
 2NH3(g);△H= -92.4 kJ/mol,
2NH3(g);△H= -92.4 kJ/mol,①合成氨工业中采取的下列措施可以用勒夏特列原理解释的是(填选项序号)_______。
a.用铁触媒加快化学反应速率
b.采用较高压强(20 MPa~50 MPa)
c.将原料气中的少量CO等气体净化除去
d.将生成的氨液化并及时从体系中分离出来
②一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。
a.若容器容积恒定,达到平衡时气体的压强为原来的7/8,N2的转化率为а1,此时,反应放热为_________kJ;
b.若容积为4L,当进行到第4分钟时达到平衡,生成NH3为1.0 mol,则从开始到达平衡时NH3的平均速率v(NH3)=_________。
c.若容器压强恒定,则达到平衡时,容器中N2的转化率为а2,则а2_______а1(填“>、<或=”)。
(2)以氨气、空气为主要原料制硝酸。
①NH3被氧气催化氧化生成NO的反应的化学方程式是______________________。
②硝酸厂常用如下2种方法处理尾气。
a.催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是___________________。
b.碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是_______________。
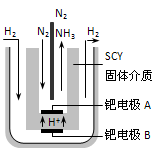
(3)随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)。钯电极A是电解池的_______极(填“阳”或“阴”),该极上的电极反应式是__________________ 。
实验步骤:
向试管中加入8mLNaOH溶液,再加入2mL乙酸乙酯,用直尺量出乙酸乙酯的高度.再把试管放入70℃的水浴中,每隔1min将其取出,振荡,静置,立即测量并记录剩余酯层的高度.再迅速放回水浴中继续加热,如此反复进行.改变NaOH溶液浓度,重复实验.
数据记录:
乙酸乙酯水解后剩余的高度/min
| 组别 | C(NaOH)/mol?L-1 | 时间/min | ||||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 1 | 0.5 | 10.0 | 9.0 | 8.0 | 7.5 | 7.0 | 6.5 | 6.5 | 6.5 | 6.5 |
| 2 | 1.0 | 10.0 | 8.5 | 7.0 | 6.0 | 5.0 | 4.5 | 4.5 | 4.5 | 4.5 |
| 3 | 2.0 | 10.0 | 8.0 | 6.0 | 4.5 | 3.0 | 2.0 | 1.5 | 1.5 | 1.5 |
(1)完成上述对比实验时,每组实验都必须控制不变的因素有
(2)分析上述数据,得到乙酸乙酯水解速率的结论是:
①NaOH溶液浓度越大,水解速率越
(3)结论②的理论解释是
(4)欲使乙酸乙酯完全水解,可采取的措施是
(5)有同学认为有必要用蒸馏水代替NaOH溶液重复试验,对数据进行修正,主要原因是