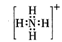网址:http://m.1010jiajiao.com/timu3_id_395828[举报]
请按要求填空:

(1)①B的电子式是


(2)D与G反应的化学方程式是
| ||
| ||
(3)已知C的燃烧热是1300kJ/mol,表示C的燃烧热的热化学方程式是
| 5 |
| 2 |
| 5 |
| 2 |
(4)将G溶于水配成溶液,简述检验该溶液G中所含阳离子的操作方法:
(5)常温下0.1mol/L的J溶液中c(H+)/c(OH-)=1×10-8,下列叙述错误的是
A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1mol/L的J溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH值为9;
(6)单质F在工业上有重要的用途是
(NH4)2Fe(SO4)2·6H2O俗名摩尔盐,价格便宜,可用来净水或治疗缺铁性贫血等,是一种重要的化工原料。
(1)摩尔盐的水溶液呈?????? 色。
(2)c(Fe2+)相同的摩尔盐和硫酸亚铁两溶液比较,物质的量浓度较大的是????? 。
(3)甲乙两位同学想测定一瓶摩尔盐的纯度。甲同学设计的实验装置如图1:
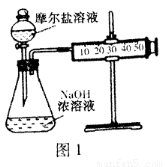
从上图推断甲同学想通过测定??????? 计算摩尔盐的纯度。该方案的不足之处在于??????????????? 。
(4)乙同学在甲同学的基础上做了改进,其实验装置如图2:
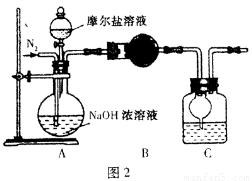
则B与C中的试剂分别是???????????? 和??????????????? 。C中干燥管的作用是???????????????????????? 。乙同学称取了10.0g的摩尔盐样品,若实验完毕后测得洗气瓶及瓶内溶液共增重O.68 g,则依此数据推算这份摩尔盐的纯度为?????? %(答案精确到小数点后第一位)。
查看习题详情和答案>>
磷酸氢二铵[(NH4)2HPO4]可用作复合肥料。关于该物质的下列说法不正确的是( )
A.HPO42-中含有共价键,其中P的化合价为+5价
B.是一种离子化合物,其中铵根离子的电子式为
C.该化合物中所有原子均满足8电子稳定结构
D.其中P元素的质量分数比N元素的质量分数高
【解析】HPO42-中的元素全部是非金属元素,因此形成的化学键是共价键,H是+1价的,O是-2价的,所以P是+5价的,A正确。铵盐都是离子化合物,B正确。H元素不可能满足8电子稳定结构,C是错误的。P的相对原子质量是31,而2个N原子才是28,所以选项D是正确的。答案选C。
查看习题详情和答案>>
X、Y、M、Z四种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素。下列说法不正确的是( )
A.化合物YZ3极易溶解于水
B.Z与M可以形成含18个电子的化合物
C.12g 14X中含有中子的物质的量为8mol
D.由上述四种元素组成的某盐可能受热易分解
【解析】地壳中含量最多的元素是氧,即M是O。X元素原子的最外层电子数是它的电子层数的2倍,则X是C或S,若是S,则根据X、Y、Z的电子层数之和为5,可知Y和Z的均属于第一周期,不正确,所以X只能是C。因为X、Y、M、Z四种短周期主族元素的原子半径依次减小,所以Z只能是氢元素。又因为Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,所以Y是N元素。A中是氨气,正确。B中是H2O2,正确。D中可以是NH4HCO3或(NH4)2CO3,正确。12g 14X中含有中子的物质的量为 ,所以答案是C。
,所以答案是C。
查看习题详情和答案>>