网址:http://m.1010jiajiao.com/timu3_id_395753[举报]
Ⅰ.测定原理:4MnO4-+5HCHO+12H+═4Mn2++5CO2↑+11H2O;2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
Ⅱ.测定装置:部分装置如图1所示(a、b为止水夹)
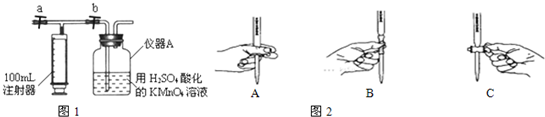
Ⅲ.实验步骤:
①如图所示,打开a,关闭b,用注射器抽取100mL新装修的室内空气.关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液(25.00mL1.00×10-3mol?L-1)中,使其充分吸收.再如此重复几次.
②将仪器A中的溶液全部转入锥形瓶中,用2.00×10-3mol?L-1的草酸(H2C2O4)标准溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液的体积.
请回答问题:
(1)仪器A的名称为______.实验步骤①重复几次后,发现仪器A中的溶液完全褪色了,处理的方法是______.
(2)实验步骤②的滴定过程中操作滴定管的图示如图2正确的是______(填编号).
(3)判断到达滴定终点的实验现象是______
(4)在滴定过程中,下列仪器中不必要用到的有______.(用编号表示).
①酸式滴定管②碱式滴定管③pH计④玻璃棒⑤锥形瓶
(5)以下实验操作会导致甲醛含量偏低的是______(用相应的编号填写)
A.注射器压送气体时速度过快
B.仪器A中的溶液转入锥形瓶后,没有洗涤仪器A.
C.在滴定前装有草酸标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失
D.锥形瓶中没有用待装液润洗,瓶中有少量水
E.滴定开始时仰视读数,滴定终点时俯视读数.
某研究性学习小组设计了如下二组实验:
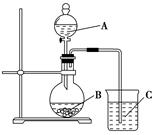
(I)实验验证元素周期律中, 非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。设计了如下图装置以验证氮、碳、硅元素的非金属性强弱。
设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成。
(1)写出所选用物质的化学式:
A: ,B: ,C: 。
(2)写出烧杯中发生反应的离子方程式: 。
(Ⅱ )为比较Fe3+和Cu2+对H2O2的催化效果,甲、乙两位同学分别设计了如图一、图二所示的实验。
(1)图一可通过观察
定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,或者将FeCl3溶液改成物质的量浓度为 mol/L的Fe2(SO4)3溶液。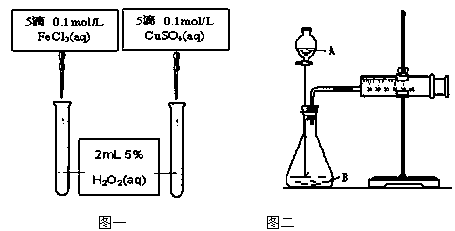
(2)检查图二装置气密性的方法是 ;
图二所示实验中需测量的数据是 。
某研究性学习小组设计了如下二组实验:
(I)实验验证元素周期律中, 非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。设计了如下图装置以验证氮、碳、硅元素的非金属性强弱。

设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成。
(1)写出所选用物质的化学式:
A: ,B: ,C: 。
(2)写出烧杯中发生反应的离子方程式: 。
(Ⅱ )为比较Fe3+和Cu2+对H2O2的催化效果,甲、乙两位同学分别设计了如图一、图二所示的实验。
(1)图一可通过观察
定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,或者将FeCl3 溶液改成物质的量浓度为 mol/L 的Fe2(SO4)3溶液。

(2)检查图二装置气密性的方法是 ;
图二所示实验中需测量的数据是 。
查看习题详情和答案>>
(I)实验验证元素周期律中, 非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。设计了如下图装置以验证氮、碳、硅元素的非金属性强弱。
设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成。
(1)写出所选用物质的化学式:
A: ,B: ,C: 。
(2)写出烧杯中发生反应的离子方程式: 。
(Ⅱ )为比较Fe3+和Cu2+对H2O2的催化效果,甲、乙两位同学分别设计了如图一、图二所示的实验。
(1)图一可通过观察
定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,或者将FeCl3溶液改成物质的量浓度为 mol/L的Fe2(SO4)3溶液。
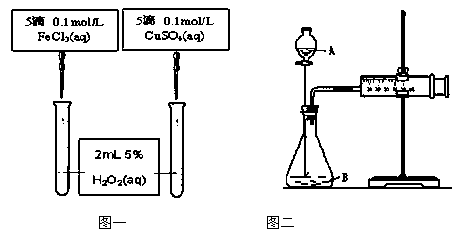
(2)检查图二装置气密性的方法是 ;
图二所示实验中需测量的数据是 。
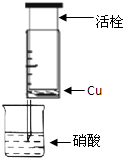 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.(1)甲组同学设计如图装置来证实稀硝酸与铜反应,步骤如下.
A、检验50ml针筒的气密性.
B、抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后
C、将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住.
回答以下相关问题:
①B中应补充的操作是
②一段时间后在针筒内观察到溶液颜色为蓝色,有
③反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是
(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如下:
| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
①一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?(填“同意”或“不同意”)
②另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色.为了验证推断是否正确,三位同学分别设计了三种方案,并进行验证:
方案一:将绿色溶液转移至试管,并给试管加热片刻,立即看到大量红棕色气体产生.认为该气体一定是溶解在溶液中的NO2,但也有同学持有异议.请分析原因
方案二:用双氧水和二氧化锰制得氧气,并把氧气缓缓通入绿色溶液中,观察溶液颜色变为蓝色.请用方程式表示溶液颜色变化的反应原理
方案三:往蓝色溶液中缓缓通入NO2气体,溶液颜色变绿色.
③从环保的角度看,你认为三个方案中最好的是哪一个