摘要:3."类推"是一种常用的学习方法.但有时会产生错误的结论.下列类推结论中正确的是 A.ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4,则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 B.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3,则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 C.晶体中有阴离子.必有阳离子,则晶体中有阳离子.必有阴离子 D.干冰(CO2)是分子晶体.则SiO2也是分子晶体
网址:http://m.1010jiajiao.com/timu3_id_394282[举报]
 图表法、图象法是常用的科学研究方法.
图表法、图象法是常用的科学研究方法.(Ⅰ)电离能是指由蒸气状态的孤立原子失去电子形成阳离子需要的能量.从中性原子中移去第一个电子所需要的能量为第一电离能(I1),移去第二个电子所需要的能量为第二电离能(I2),依次类推.
现有5种元素L、M、N、O、P,其I1~I3分别如下表,根据表中数据判断其中的金属元素有
M、N、O
M、N、O
,稀有气体元素是P
P
,最活泼的金属是M
M
,显二价的金属是O
O
.| 元 素 | I1/eV | I2/eV | I3/eV |
| L | 13.0 | 23.9 | 40.0 |
| M | 4.3 | 31.9 | 47.8 |
| N | 5.7 | 47.4 | 71.8 |
| O | 7.7 | 15.1 | 80.3 |
| P | 21.6 | 41.1 | 65.2 |
(1)该反应的化学方程式为
2P+3Q?2M
2P+3Q?2M
(2)若M、P、Q均为气体,反应达平衡时:
①体系的压强是开始时的
| 13 |
| 16 |
| 13 |
| 16 |
0.02mol/L?min
0.02mol/L?min
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为
放热
放热
反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时减小
减小
(填增大、减小或相等).(3)此反应达平衡后,若只加大体系压强,M的物质的量增加,若M是气体,则Q的聚集状态是
气态
气态
.某温度、压强下,将一定量反应物通入密闭容器进行反应:
SiCl4(g)+2H2(g)  Si(s)+4HCl(g);ΔH
=" +Q" kJ·mol-1(Q>0),下列叙述正确的是
Si(s)+4HCl(g);ΔH
=" +Q" kJ·mol-1(Q>0),下列叙述正确的是
A.反应过程中,若增大压强,能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.若单位时间内生成x molHCl的同时,生成x molH2,则反应达到平衡状态
D.使用过量的H2或升高温度都可以提高SiCl4的转化率
查看习题详情和答案>>
利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为 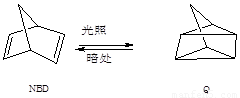 ; △H
="+88.62" kJ·mol-1
; △H
="+88.62" kJ·mol-1
以下叙述不正确的是
A.Q的一氯代物只有3种 B.NBD和Q互为同分异构体
C.NBD的能量比Q的能量低 D.NBD不能使酸性KMnO4溶液褪色而Q能
查看习题详情和答案>>
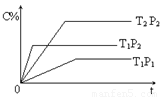
 cC(g);△H="Q" kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( )
cC(g);△H="Q" kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( )
 pC(g) ?H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
pC(g) ?H=" Q" kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是