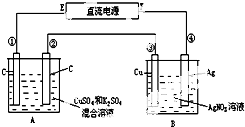
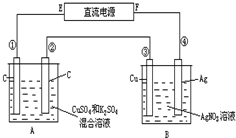
摘要:27.如图所示.通电5min后.第③极增重2.16g.同时在A池中收集到标准状况下的气体224mL.设A池中原混合液的体积为200mL.求通电前A池原混合溶液中Cu2+的浓度.28.用KMnO4晶体和浓盐酸制取氧气和氯气.取0.2molKMnO4晶体先加热制得一定量的氧气后停止加热.再将残留物与过量浓盐酸混合.加热.得到Cl2.此时溶液中的主要离子是K+.Mn2+.H+.Cl-.计算: (1)KMnO4晶体完全分解时制得的氧气在标准状况下的体积. 中完全分解的固体产物与过量的浓盐酸反应.可制得Cl2的物质的量. (3)若最后得到的Cl2为0.48mol.则KMnO4制氧气时的分解率.
网址:http://m.1010jiajiao.com/timu3_id_391952[举报]
如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为100mL,

(1)求通电前A池中原混合溶液中Cu2+的物质的量浓度.
(2)求电解后A池溶液的pH.
查看习题详情和答案>>

(1)求通电前A池中原混合溶液中Cu2+的物质的量浓度.
0.05mol/L
0.05mol/L
(2)求电解后A池溶液的pH.
1
1
. 如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL,求通电前A池中原混合溶液Cu2+的浓度.
如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL,求通电前A池中原混合溶液Cu2+的浓度.