摘要:5.一定条件.反应CO2,△H>0达到平衡状态.下列说法正确的是 A.平衡混合气中.CO物质的量浓度一定是CO2物质的量浓度的2倍 B.若升高温度.CO2的转化率增大 C.若增大CO2的浓度.△H增大 D.若增大压强.平衡不移动
网址:http://m.1010jiajiao.com/timu3_id_391810[举报]
一定条件下,可逆反应C(s)+CO2(g)?2CO(g);△H>0,达到平衡状态,现进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积; ④减少体系中CO的量.
上述措施中一定能使反应的正反应速率显著加快的是( )
①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积; ④减少体系中CO的量.
上述措施中一定能使反应的正反应速率显著加快的是( )
| A、①②③④ | B、①③ | C、①② | D、①③④ |
一定条件下,可逆反应C(s)+CO2(g)?2CO(g)△H>0,达到平衡状态,现进行如下操作:①减少体系中CO的量;②缩小反应体系的体积;③增加反应物C(s)的用量;④升高反应体系的温度;上述措施中一定能使反应的正反应速率显著加快的是( )
| A、①②③④ | B、②④ | C、③④ | D、①②④ |
一定条件下,可逆反应C(s) + CO2(g) 2CO(g) △H>0,达到平衡状态,进行如下操作:
2CO(g) △H>0,达到平衡状态,进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量;
③缩小反应体系的体积; ④减少体系中CO的量。
上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④ B.①③ C.①② D.①③④
查看习题详情和答案>>
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g)

FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)=______.
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是______(填序号).
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将______(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛.
①FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液.若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式:______.
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂.高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为______.
(5)已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol;2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol.写出CO和H2O(g)作用生成CO2和H2的热化学方程式______.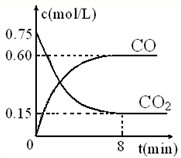
查看习题详情和答案>>
Fe(s)+CO2(g)

FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)=______.
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是______(填序号).
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将______(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛.
①FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液.若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式:______.
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂.高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为______.
(5)已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol;2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol.写出CO和H2O(g)作用生成CO2和H2的热化学方程式______.
