摘要:17.下列说法正确的是 ( ) A.碳酸氢根离子的电离方程式: HCO3-+H2O H3O++ CO32- B.从上到下.卤族元素的非金属性逐渐减弱.故氢卤酸的酸性依次减弱 C.因为氧化性:HClO>稀H2SO4.所以非金属性:Cl>S D.NaCl晶体中每个Na+同时吸引着6个Cl-.CsCl晶体中每个Cl-同时吸引着6个 Cs+
网址:http://m.1010jiajiao.com/timu3_id_391578[举报]
下列说法正确的是
A.碳酸氢根离子的电离方程式: HCO3-+H2O![]() H3O++ CO32-
H3O++ CO32-
B.从上到下,卤族元素的非金属性逐渐减弱,故氢卤酸的酸性依次减弱
C.因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
D.NaCl晶体中每个Na+同时吸引着6个Cl-,CsCl晶体中每个Cl-同时吸引着6个Cs+
查看习题详情和答案>>下列说法正确的是
A.碳酸氢根离子的电离方程式: HCO3-+H2O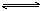 H3O++ CO32- H3O++ CO32- |
| B.从上到下,卤族元素的非金属性逐渐减弱,故氢卤酸的酸性依次减弱 |
| C.因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S |
| D.NaCl晶体中每个Na+同时吸引着6个Cl-,CsCl晶体中每个Cl-同时吸引着6个Cs+ |
下列说法正确的是
[ ]
A.碳酸氢根离子的电离方程式: HCO3-+H2O H3O++ CO32-
H3O++ CO32-
B.从上到下,卤族元素的非金属性逐渐减弱,故氢卤酸的酸性依次减弱
C.因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
D.NaCl晶体中每个Na+同时吸引着6个Cl-,CsCl晶体中每个Cl-同时吸引着6个Cs+
查看习题详情和答案>>
 H3O++ CO32-
H3O++ CO32- B.从上到下,卤族元素的非金属性逐渐减弱,故氢卤酸的酸性依次减弱
C.因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
D.NaCl晶体中每个Na+同时吸引着6个Cl-,CsCl晶体中每个Cl-同时吸引着6个Cs+
下列说法正确的是
A.碳酸氢根离子的电离方程式: HCO3-+H2O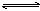 H3O++ CO32- H3O++ CO32- |
| B.从上到下,卤族元素的非金属性逐渐减弱,故氢卤酸的酸性依次减弱 |
| C.因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S |
| D.NaCl晶体中每个Na+同时吸引着6个Cl-,CsCl晶体中每个Cl-同时吸引着6个Cs+ |