网址:http://m.1010jiajiao.com/timu3_id_390453[举报]
(1)由X、Y组成的最简单化合物可作某一燃料电池的
(2)Z与氧组成的某种化合物可作为潜水员的供氧剂,该化合物中含有的化学键是
(3)即热饭盒中,有W的单质与铁粉、固体食盐组成混合物A,使用时将水加入A中,几分钟后饭菜变热了.从能量转化角度看,该过程是化学能转化为
| ||
| ||
(4)500℃时,密闭容器中充入1mol/L CO2和3mol/L H2发生反应:CO2(g)+3H2(g)
| 加热、加压 |
| 催化剂 |
| 反应时间/min | 3 | 5 | 7 | 10 | 13 |
| c(CO2)/mol?L-1 | 0.50 | 0.37 | 0.30 | 0.25 | 0.25 |
(5)已知:298K时,Ca(s)=Ca2+(g)+2e-△H=1807kJ/mol
| 1 |
| 2 |
Ca2+(g)+O2-(g)=CaO(s)△H=-3528.5kJ/mol
298K时,金属钙和氧气反应生成CaO固体的热化学方程式为
| 1 |
| 2 |
| 1 |
| 2 |
| A、元素C形成的单质可以在点燃条件分别与元素A、B、D形成的单质化合,所得化合物均存在共价键 | B、元素B、C、D的原子半径由大到小的顺序为:r(D)>r(C)>r(B) | C、1.0 L 0.1 mol/L戊溶液中含阴离子总的物质的量小于0.1 mol | D、1 mol甲与足量的乙完全反应共转移约1.204×1024个电子 |
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,而辛是由C元素形成的单质。已知:甲 + 乙 =丁 +辛,甲 + 丙 = 戊 + 辛;常温下0.1 mol/L 丁溶液的pH为13,则下列说法正确的是
A.元素C形成的单质可以在点燃条件分别与元素A、B、D形成的单质化合,所得化合物均存在共价键
B.元素B、C、D的原子半径由大到小的顺序为:r(D) > r(C) > r(B)
C.1.0 L 0. 1 mol/L戊溶液中含阴离子总的物质的量小于0. 1 mol
D.1 mol甲与足量的乙完全反应共转移约1.204 × 1024个电子
A.元素C形成的单质可以在点燃条件分别与元素A、B、D形成的单质化合,所得化合物均存在共价键
B.元素B、C、D的原子半径由大到小的顺序为:r(D) > r(C) > r(B)
C.1.0 L 0. 1 mol/L戊溶液中含阴离子总的物质的量小于0. 1 mol
D.1 mol甲与足量的乙完全反应共转移约1.204 × 1024个电子
(13分)A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成。B、C的组成元素相同,且C的摩尔质量比B大80g/mol ,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
二、 下表为B与F实验的部分内容
| ①在含B的溶液中加入稀 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出B与稀![]() 反应的离子方程式
反应的离子方程式
写出②中反应的化学方程式
(3)现由6种粒子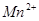 、
、 、
、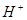 、
、 、
、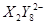 (C中含有的阴离子),
(C中含有的阴离子),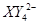 完成一个离子方程式,已知
完成一个离子方程式,已知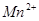 为还原剂,得到1mol
为还原剂,得到1mol![]() 需氧化剂的物质的量为 mol
需氧化剂的物质的量为 mol
(4)化合物D和E相互转化D E,若有D和E ·
 H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为 g,E ·
H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为 g,E ·![]()
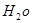 的化学式为
的化学式为
查看习题详情和答案>>