摘要:19. VIII ( 2 ) l :2 ( 3 )③ ( 4 ) 3Fe2+ + NO3- + 4H+ + = 3Fe3+ + NO↑+2H2O ( 5 ) Fe2O3+3KNO3+4KOH2K2FeO4+3KNO2+2H2O
网址:http://m.1010jiajiao.com/timu3_id_390104[举报]
(一)请完成下列各空:
(1)pH=a的CH3COOH溶液稀释100倍后所得溶液pH
(2)0.01mol?L-1CH3COOH溶液的pH
(3)0.1mol?L-1CH3COONa溶液的pH
(二)常温下有浓度均为0.05mol/L的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3?H2O,回答相关问题:
(1)上述溶液中,可发生水解的是
(2)在NaHCO3溶液中,离子浓度大小的关系正确的是
A、c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B、c(Na+)=c(HCO3-)>c(H+)>c(OH-)
C、c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)
D、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
(3)向④中加入少量NH4Cl固体,此时c(NH4+/OH-)的值
(4)若将③和④的溶液混合后,溶液恰好呈中性,则混合前③的体积
(5)取10mL的③溶液加水稀释到500mL,则此溶液中由水电离出的c(H+)=
查看习题详情和答案>>
(1)pH=a的CH3COOH溶液稀释100倍后所得溶液pH
<
<
a+2(填“>”或“<”)(2)0.01mol?L-1CH3COOH溶液的pH
>
>
2(填“>”或“<”)(3)0.1mol?L-1CH3COONa溶液的pH
>
>
7(填“>”或“<”)(二)常温下有浓度均为0.05mol/L的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3?H2O,回答相关问题:
(1)上述溶液中,可发生水解的是
①②
①②
(填序号)(2)在NaHCO3溶液中,离子浓度大小的关系正确的是
CD
CD
(填字母)A、c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B、c(Na+)=c(HCO3-)>c(H+)>c(OH-)
C、c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)
D、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
(3)向④中加入少量NH4Cl固体,此时c(NH4+/OH-)的值
增大
增大
(“增大”、“减小”或“不变”)(4)若将③和④的溶液混合后,溶液恰好呈中性,则混合前③的体积
小于
小于
④的体积(“大于”、“小于”或“等于”)(5)取10mL的③溶液加水稀释到500mL,则此溶液中由水电离出的c(H+)=
10-11
10-11
mol/L.常温下有浓度均为0.5mol/L的四种溶液:①碳酸钠溶液 ②碳酸氢钠溶液 ③盐酸 ④氨水.请根据题目要求回答下列问题:
(1)上述溶液中,可发生水解反应的 (填序号,下同),在发生水解反应的溶液中pH最大的是 .
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是 .
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中
的值 (填“增大”或“减小”或“不变”)
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是 .
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)= mol/L.
查看习题详情和答案>>
(1)上述溶液中,可发生水解反应的
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中
| c(OH-) | c(NH3?H2O) |
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)=
 常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水
常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水试回答下列问题:
(1)上述溶液中有水解反应发生的是
①②
①②
(填编号,下同),溶液中溶质存在电离平衡的是②④
②④
;(2)比较①、②溶液,pH值较大的是
①
①
;(3)在溶液④中加入少量NH4Cl固体,此时C(NH4+)/C(OH-)的值将
变大
变大
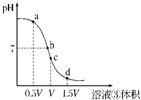
(填“变小”、“变大”或“不变”);(4)用溶液③滴定V mL溶液④其滴定曲线如图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点,水的电离程度最大的是
c
c
点,理由是恰好完全反应生成氯化铵溶液时,铵根离子水解显酸性,促进水的电离,酸过量或碱过量对水的电离起到抑制作用
恰好完全反应生成氯化铵溶液时,铵根离子水解显酸性,促进水的电离,酸过量或碱过量对水的电离起到抑制作用
;②a点溶液中离子浓度大小关系是
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
;③取少量c点溶液于试管,再滴加0.1mol/L NaOH溶液至中性.此时溶液中除H+、OH-外,离子浓度大小关系是
C(Cl-)=c(NH4+)+C(Na+)
C(Cl-)=c(NH4+)+C(Na+)
.
(1)有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时丙为负极;把乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出.这四种金属的活动性由强到弱的顺序是 .
(2)向5mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为 .
(3)现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是 .
①20mL 0.01mol?L-1 KCl溶液
②30mL 0.02mol?L-1 CaCl2溶液
③40mL 0.03mol?L-1 HCl溶液
④10mL蒸馏水
⑤50mL 0.05mol?L-1 AgNO3溶液
(4)某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气.此电池的负极发生的电极反应式是 ;
(5)某酸H2B在水溶液中有如下变化:H2B═H++HB-;HB-?H++B2-;现有溶液0.10mol/L、100mL,试回答以下问题:
①溶液中的H+物质的量取值范围是:
②已知0.1mol?L-1 NaHB溶液的pH=2,则0.1mol?L-1 H2B溶液中氢离子的物质的量浓度可能是 0.11mol?L-1(填“<”,“>”,或“=”).
查看习题详情和答案>>
(2)向5mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为
(3)现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20mL 0.01mol?L-1 KCl溶液
②30mL 0.02mol?L-1 CaCl2溶液
③40mL 0.03mol?L-1 HCl溶液
④10mL蒸馏水
⑤50mL 0.05mol?L-1 AgNO3溶液
(4)某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气.此电池的负极发生的电极反应式是
(5)某酸H2B在水溶液中有如下变化:H2B═H++HB-;HB-?H++B2-;现有溶液0.10mol/L、100mL,试回答以下问题:
①溶液中的H+物质的量取值范围是:
②已知0.1mol?L-1 NaHB溶液的pH=2,则0.1mol?L-1 H2B溶液中氢离子的物质的量浓度可能是
(10分)25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因 (用离子方程式表示);
(2)混合溶液中由水电离出的c(H+) 0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(填“>”、“<”或“=”)
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c (Na+)-c (A-)= mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7 (填“>”、“<”或“=”);
(5)将相同温度下相同浓度的四种溶液:
A.NH3·H2O B.NH4A C.NH4HSO4 D.NH4Cl按NH4+浓度由大到小的顺序排列 (填序号)
查看习题详情和答案>>