摘要:14.下列有关说法一定正确的是 A.依据相对分子质量能判断组成和结构相似的分子晶体的熔沸点的高 低 B.NaCl晶体中Na+和Cl-存在如图所示的位置关系 C.SiC晶体的网状结构中.由共价键形成的最小的环上有6个碳原子 D.金属晶体的熔点都比原子晶体的熔点低
网址:http://m.1010jiajiao.com/timu3_id_389708[举报]
下列有关化学实验的说法不正确的是
[ ]
A.水果中维生素C含量的测定,可以向一定体积的果汁中滴加碘水,用淀粉溶液作指示剂,终点现象为:溶液蓝色褪去且半分钟内不变色
B.苯和甲苯分别在浓硫酸条件下与浓硝酸反应,通过产物对比可以探究基团间的相互影响:该实验的结论是甲基对苯环产生了影响
C.乙醚是一种重要的有机溶剂,在苯酚和乙醇性质比较实验中,将等量的两者分别溶于乙醚,再投入金属钠,从而可以比较出羟基氢的活性
D.物质的分离提纯方法之一为“筛分”:如胶体—渗析法分离提纯;浊液—过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子”
查看习题详情和答案>>
B.苯和甲苯分别在浓硫酸条件下与浓硝酸反应,通过产物对比可以探究基团间的相互影响:该实验的结论是甲基对苯环产生了影响
C.乙醚是一种重要的有机溶剂,在苯酚和乙醇性质比较实验中,将等量的两者分别溶于乙醚,再投入金属钠,从而可以比较出羟基氢的活性
D.物质的分离提纯方法之一为“筛分”:如胶体—渗析法分离提纯;浊液—过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子”
工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)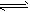 CH3OH(g) △H
CH3OH(g) △H
(1)判断反应达到平衡状态的依据是(填字母序号,下同)____
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
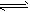 CH3OH(g) △H
CH3OH(g) △H (1)判断反应达到平衡状态的依据是(填字母序号,下同)____
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。

①由表中数据判断△H____(填“>”“=”或“<”)0;
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO) =
0.2 mol/L,则CO的转化率为___________,此时的温度为_________。
(3)要提高CO的转化率,可以采取的措施是_________。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(4) 300℃时,在一定的压强下,5 mol CO与足量的H2在催化剂的作用下恰好完全反应变化的热量为
454kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO) =
0.2 mol/L,则CO的转化率为___________,此时的温度为_________。
(3)要提高CO的转化率,可以采取的措施是_________。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(4) 300℃时,在一定的压强下,5 mol CO与足量的H2在催化剂的作用下恰好完全反应变化的热量为
454kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
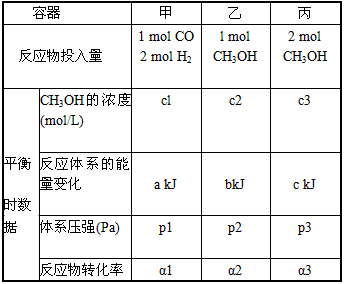
下列说法正确的是____。
A.2c1>c3 B.a+b<90. 8 C.2P2<p3 D.α1+α3<1
查看习题详情和答案>>
A.2c1>c3 B.a+b<90. 8 C.2P2<p3 D.α1+α3<1
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
(1)判断反应达到平衡状态的依据是(填字母序号,下同)____。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
 CH3OH(g) △H
CH3OH(g) △H(1)判断反应达到平衡状态的依据是(填字母序号,下同)____。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
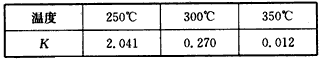
①由表中数据判断△H____0(填“>”“=”或“<”);
②某温度下,将2 mol CO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2
mol/L,则CO的转化率为_________,此时的温度为__________。
(3)要提高CO的转化率,可以采取的措施是__________。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(4)300℃、一定的压强下,5 mol CO与足量的H2在催化剂的作用下恰好完全反应变化的热量为454 kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
②某温度下,将2 mol CO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2
mol/L,则CO的转化率为_________,此时的温度为__________。
(3)要提高CO的转化率,可以采取的措施是__________。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(4)300℃、一定的压强下,5 mol CO与足量的H2在催化剂的作用下恰好完全反应变化的热量为454 kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
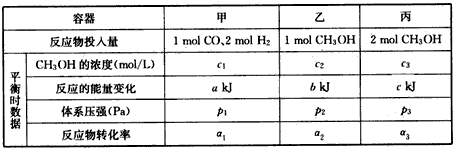
下列说法正确的是_________。
A.2c1>c3 B.a+b<90.8 C.2P2<P3 D.a1+a3<1
查看习题详情和答案>>
A.2c1>c3 B.a+b<90.8 C.2P2<P3 D.a1+a3<1
下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):

根据上述数据问题。
(1)下列物质本身具有的能量最低的是 _____(填序号)
A.H2 B.Cl2 C.Br2 D.I2
化合物HCl、HBr、HI中______受热时最稳定。
(2)1molH2在2mol Cl2中燃烧,放出热量________ kJ 。一定条件下,1mol H2分别与足量Cl2、Br2、I2反应,放出热量由多到少的顺序是________ (填序号)
A Cl2<Br2<I2 B Cl2>Br2>I2
(3)下列有关化学键及键参数的说法中正确的是__________(填序号)
① 原子或分子间的相互作用叫化学键
② 氯分子中两个氯原子间的距离是键长
③ 键长的大小与成键原子的半径和成键数目有关
④ 键角是描述分子立体结构的重要参数
(4)下列事实不能用键能的大小来解释的是___________(填序号)
A.乙炔比氮气均含三键但是前者比后者容易发生加成反应
B.N2、O2、F2跟氢气的反应能力依次增强
C.硝酸是挥发性酸,而硫酸、磷酸是难不挥发性酸
(5)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。
①写出(CN)2与苛性钠溶液反应的离子方程式______________________;
②已知氰分子中键与键之间的夹角为180.,并有对称性, 则结构式为_______
③氰分子中碳原子为_______杂化;一个氰分子中包含_______个σ键,____个键。
查看习题详情和答案>>
(1)下列物质本身具有的能量最低的是 _____(填序号)
A.H2 B.Cl2 C.Br2 D.I2
化合物HCl、HBr、HI中______受热时最稳定。
(2)1molH2在2mol Cl2中燃烧,放出热量________ kJ 。一定条件下,1mol H2分别与足量Cl2、Br2、I2反应,放出热量由多到少的顺序是________ (填序号)
A Cl2<Br2<I2 B Cl2>Br2>I2
(3)下列有关化学键及键参数的说法中正确的是__________(填序号)
① 原子或分子间的相互作用叫化学键
② 氯分子中两个氯原子间的距离是键长
③ 键长的大小与成键原子的半径和成键数目有关
④ 键角是描述分子立体结构的重要参数
(4)下列事实不能用键能的大小来解释的是___________(填序号)
A.乙炔比氮气均含三键但是前者比后者容易发生加成反应
B.N2、O2、F2跟氢气的反应能力依次增强
C.硝酸是挥发性酸,而硫酸、磷酸是难不挥发性酸
(5)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。
①写出(CN)2与苛性钠溶液反应的离子方程式______________________;
②已知氰分子中键与键之间的夹角为180.,并有对称性, 则结构式为_______
③氰分子中碳原子为_______杂化;一个氰分子中包含_______个σ键,____个键。
下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
根据上述数据问题.
(1)下列物质本身具有的能量最低的是________(填序号)
A.H2
B.Cl2
C.Br2
D.I2
化合物HCl、HBr、HI中________受热时最稳定.
(2)1 mol H2在2 mol Cl2中燃烧,放出热量________kJ.一定条件下,1 mol H2分别与足量Cl2、Br2、I2反应,放出热量由多到少的顺序是________(填序号)
A.Cl2<Br2<I2
B.Cl2>Br2>I2
(3)下列有关化学键及键参数的说法中正确的是________(填序号)
①原子或分子间的相互作用叫化学键
②氯分子中两个氯原子间的距离是键长
③键长的大小与成键原子的半径和成键数目有关
④键角是描述分子立体结构的重要参数
(4)下列事实不能用键能的大小来解释的是________(填序号)
A.乙炔比氮气均含三键但是前者比后者容易发生加成反应
B.N2、O2、F2跟氢气的反应能力依次增强
C.硝酸是挥发性酸,而硫酸、磷酸是难不挥发性酸
(5)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似.
①写出(CN)2与苛性钠溶液反应的离子方程式________;
②已知氰分子中键与键之间的夹角为180°,并有对称性,则结构式为________.
③氰分子中碳原子为________杂化;一个氰分子中包含________个σ键,________个键.