摘要:22. 氢是新型清洁能源.但难储运.研究发现.合金可用来储藏氢气.镧() 和镍() 的一种合金就是储氢材料.该合金的晶胞如右图.镍原子除一个在中心外.其他都在面上.镧原子在顶点上.储氢时氢原子存在于金属原子之间的空隙中. (1)一定条件下.该贮氢材料能快速.可逆地存储和释放氢气.若每个晶胞可吸收 3 个 H2, 这一过程用化学方程式表示为: . (2)下列关于该贮氢材料及氢气的说法中.正确的是 A.该材料中镧原子和镍原子之间存在化学键.是原子晶体 B.氢分子被吸收时首先要在合金表面解离变成氢原子.同时放出热量 C.该材料贮氢时采用常温高压比采用常温常压更好 D.氢气很难液化是因为虽然其分子内氢键很强.但其分子间作用力很弱 E.己知镧和镍的第一电离能分别为 5.58eV.7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子 (3)某研究性学习小组查阅的有关镍及其化合物的性质资料如下: ①写出 Ni3+ 的核外电子排布式: ②写出将NiO(OH) 溶于浓盐酸的离子方程式: 6为正八面体结构.镍原子位于正八面体的中心.配位体CO在正八面体的六个顶点上.若把其中两个CO配位体换成 NH3 得到新的配合物.则以下物质中互为同分异构体的是 . ( 填字母编号.任填一组 )( 图中黑点为NH3.圆圈为CO.Ni略去)
网址:http://m.1010jiajiao.com/timu3_id_389694[举报]
[化学选修物质结构与性质]图1中几种“俄罗斯方块”均裁剪于长式元素周期表.特同答下列问题:
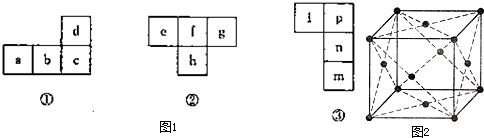
(1)a、d都是日常生活中的常见金属,常温下d在浓硝酸中发生钝化,则:元素c在周期表中的位置为第 周期 族; a的单质晶胞结构如图2.构成晶体的微粒之间的作用为 .每个晶胞中含有的原 子数为 个,晶体巾距离每个a原子最近且等距离的a原子有 个.
(2)短周期元素h的最外层电子数是其核外电子总数的
,则e、f、g的简单氢化物的沸点由高到低的次序为: > > (用化学式表达),根据杂化轨道理论和价层电子对互斥理论,h的三氯化物中h原子的杂化类型为 ,分子的空间形状为: .
(3)n的双原子分子常温下为液态.则图23一③中的四种元素均属于周期表的 区元素,m、n、p元素的电负性依次 (填“增强”或“减弱”).
查看习题详情和答案>>

(1)a、d都是日常生活中的常见金属,常温下d在浓硝酸中发生钝化,则:元素c在周期表中的位置为第
(2)短周期元素h的最外层电子数是其核外电子总数的
| 1 | 3 |
(3)n的双原子分子常温下为液态.则图23一③中的四种元素均属于周期表的
[化学-物质结构与性质]
(1)下列分子中,属于非极性分子的是
A.SO2 B.BeCl2 C.BBr3 D.COCl2
(2)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为 .
HOCHO的沸点比OHCHO高,原因是 .
(3)H+可与H2O形成H3O+,H3O+中O原子采用 杂化.H3O+中H-O-H键角比H2O中H-O-H键角大,原因为 .
(4)在BF3分子中,F-B-F的键角是 ,BF3和过量NaF作用可生成NaBF4,BF
的立体构型为 ;
(5)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为 .
查看习题详情和答案>>
(1)下列分子中,属于非极性分子的是
A.SO2 B.BeCl2 C.BBr3 D.COCl2
(2)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为
HOCHO的沸点比OHCHO高,原因是
(3)H+可与H2O形成H3O+,H3O+中O原子采用
(4)在BF3分子中,F-B-F的键角是
- 4 |
(5)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(2011?太原二模)[化学--选物质结构与性质]
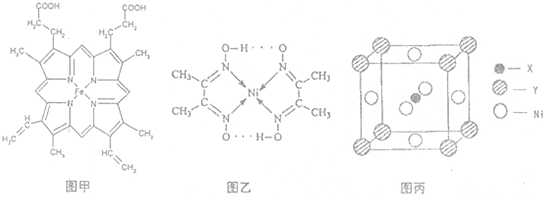
(1)如图甲,血红素含有C、H、O、N、Fe五种元素,C、H、N、O四种元素的电负性由小到大的顺序是
(2)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.Cl2、IBr、ICl沸点由高到低的顺序为
①HClO4、②HIO4、③HIO6[可写成(HO)5IO]的酸性由强到弱的顺序为
(3)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.配合物Ni(CO)4常温为流态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于
A.氢键 B.离子键 C.范德华力 D.配位键
(4)最近发现,只含X、Y和Ni三种元素的某种晶体具有超导性.X元素原子的2p能级的电子排布图为 ,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为
,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为
查看习题详情和答案>>

(1)如图甲,血红素含有C、H、O、N、Fe五种元素,C、H、N、O四种元素的电负性由小到大的顺序是
H<C<N<O
H<C<N<O
,根据以上电负性请判断H2N-CHO中C和N的化合价分别为+2
+2
和-3
-3
.基态Fe原子的核外电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2
1s22s22p63s23p63d64s2或[Ar]3d64s2
.血红素中两种N原子的杂化方式分别为sp2
sp2
、sp3
sp3
.(2)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.Cl2、IBr、ICl沸点由高到低的顺序为
BrI>ICl>Cl2
BrI>ICl>Cl2
.I+3(可看成II+2)属于多卤素阳离子,根据VSEPR模型推测I+3的空间构型为V形
V形
.多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,则A的化学式为RbCl
RbCl
.①HClO4、②HIO4、③HIO6[可写成(HO)5IO]的酸性由强到弱的顺序为
①②③
①②③
(填序号).(3)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.配合物Ni(CO)4常温为流态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于
分子
分子
晶体.如图乙配合物分子内的作用力除共价键外,还存在的两种作用力是AD
AD
(填字母编号).A.氢键 B.离子键 C.范德华力 D.配位键
(4)最近发现,只含X、Y和Ni三种元素的某种晶体具有超导性.X元素原子的2p能级的电子排布图为
 ,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为
,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为MgCNi3
MgCNi3
.(2012?福建)[化学一物质结构与性质]
(1)元素的第一电离能:Al
(2)基态Mn2+的核外电子排布式为
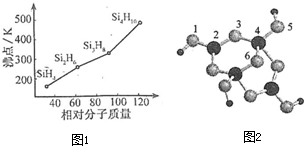
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图1所示,呈现这种变化关系的原因是
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、0、H 三种元素)的球棍模型如图2所示:
①在Xm-中,硼原子轨道的杂化类型有
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有(填序号)
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键.
查看习题详情和答案>>

(1)元素的第一电离能:Al
<
<
Si(填“>”或“<“).(2)基态Mn2+的核外电子排布式为
[Ar]3d5
[Ar]3d5
.(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图1所示,呈现这种变化关系的原因是
硅烷是分子晶体,相对分子质量越大,沸点越高
硅烷是分子晶体,相对分子质量越大,沸点越高
.(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、0、H 三种元素)的球棍模型如图2所示:
①在Xm-中,硼原子轨道的杂化类型有
SP2杂化、SP3杂化
SP2杂化、SP3杂化
;配位键存在于4号与5号
4号与5号
原子之间(填原子的数字标号); m=2
2
(填数字).②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有(填序号)
ADE
ADE
.A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键.
[化学-选修/物质结构与性质]
(1)①对硝基苯酚水合物(2C6H5NO3?3H2O)晶体属于分子晶体,实验表明,加热至94℃时该晶体失去结晶水,该晶体失去结晶水的过程,破坏的微粒间的主要作用力属于 .
②一种铜与金形成的合金,其晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子的数目之比为 .
(2)下表为元素周期表的一部分,根据此表回答下列问题:
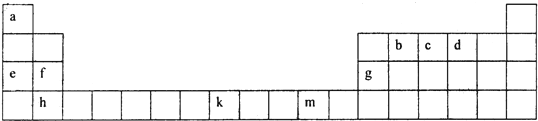
①f、g、h三种元素的第一电离能由小到大的顺序是 (用元素符号表示),b、c、d三种元素的电负性由大到小的顺序是 (用元素符号表示),b、c、d分别与a形成的简单化合物分子中,属于含有极性键的非极性分子是 .(填写化学式)
②有一种元素x和上表中所列元素k位于同周期、同一族且不相邻的位置,请写出元素x原子的基态价电子排布式 .
目前,利用金属或合金作为储氢材料的研究取得很大进展,如图是一种La-x合金储氢后的晶胞结构图.该合金储氢后,含有lmol La(镧)的合金中吸附的H2的数目为 .
③科学家把由c、d、e组成的离子化合物ecd 3和e2d在一定条件下反应得到一种白色晶体,该晶体中的阴离子为cd
,其中各原子的最外层电子均满足8电子稳定结构.该阴离子的中心原子的杂化轨道方式为 杂化,阴离子的电子式为 .
查看习题详情和答案>>
(1)①对硝基苯酚水合物(2C6H5NO3?3H2O)晶体属于分子晶体,实验表明,加热至94℃时该晶体失去结晶水,该晶体失去结晶水的过程,破坏的微粒间的主要作用力属于
②一种铜与金形成的合金,其晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子的数目之比为
(2)下表为元素周期表的一部分,根据此表回答下列问题:

①f、g、h三种元素的第一电离能由小到大的顺序是
②有一种元素x和上表中所列元素k位于同周期、同一族且不相邻的位置,请写出元素x原子的基态价电子排布式

目前,利用金属或合金作为储氢材料的研究取得很大进展,如图是一种La-x合金储氢后的晶胞结构图.该合金储氢后,含有lmol La(镧)的合金中吸附的H2的数目为
③科学家把由c、d、e组成的离子化合物ecd 3和e2d在一定条件下反应得到一种白色晶体,该晶体中的阴离子为cd
3- 4 |