摘要:22. 某校化学小组学生利用下图所示装置进行“乙二酸晶体受热分解 的实验.并验证分解产物中有CO2和CO.(图中夹持装置及尾气处理装置均已略去) (1)①证明分解产物中有CO2的现象是 . ②证明分解产物中有CO的现象是 . (2)装置C中盛放NaOH溶液的作用是 . (3)实验结束后.装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜): . (4)草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4.MnO2氧化.写出KMnO4.和草酸钠溶液在稀硫酸中反应的离子方程式是: .
网址:http://m.1010jiajiao.com/timu3_id_389581[举报]
 某学生做浓硫酸性质的实验:
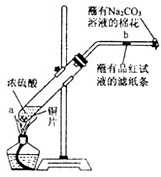
某学生做浓硫酸性质的实验:在一支试管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃管口处缠放一团蘸有NaOH溶液的棉花.加热试管,观察现象.
回答下列问题:
(1)写出试管中发生反应的化学方程式
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||
(2)试管中的液体反应一段时间后,b处滤纸条的变化为
蘸有品红溶液的滤纸褪色
蘸有品红溶液的滤纸褪色
,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为滤纸变红
滤纸变红
.(3)蘸有NaOH溶液的棉花团作用是
吸收多余的SO2,防止污染空气
吸收多余的SO2,防止污染空气
.(4)硫酸型酸雨的形成过程可用下列反应中的
AB
AB
来表示.A.2SO2+O2
| 催化剂 |
B.SO3+H2O═H2SO4
C.SO2+H2O2═H2SO4.
 某学生做浓硫酸性质的实验:
某学生做浓硫酸性质的实验:实验一:在一个白色的点滴板的孔穴中先分别加入小纸片、少量CuSO4?5H2O;然后再分别滴入几滴浓硫酸,观察现象.回答下列问题:
(1)浓硫酸滴入小纸片上,小纸片变
(2)浓硫酸滴入CuSO4?5H2O中,胆矾
实验二:如图所示进行实验:玻璃管中放的是蘸有品红溶液的滤纸,玻璃管口处缠放蘸有NaOH溶液的棉花.给试管加热,观察现象.一段时间以后,停止加热.
回答下列问题:
(3)写出a处反应的化学方程式
(4)试管中的液体反应一段时间后,b处滤纸条的变化是
(5)写出C处Na2CO3的作用
 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
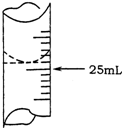
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如右图,则此时消耗标准溶液的体积为
23.70mL
23.70mL
;(2)乙学生做了三组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol?L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
0.1092mol?L-1
0.1092mol?L-1
(小数点后保留四位);(3)下列哪些操作会使测定结果偏高
AC
AC
(填序号).A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(4)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ?mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-207.0KJ/mol;
CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-207.0KJ/mol;
.一次性筷子、一次性饭盒的安全受到社会的关注.专家介绍说,正规的一次性筷子所用的
原料都是质地较好的木材,不用特殊加工.但是很多小作坊为了降低成本,使用劣质木材,为筷子看上去
白一些,他们常用硫磺进行熏蒸漂白,结果造成二氧化硫严重超标,同时硫磺中含铅、汞等重金属,也会
对人体造成铅中毒或汞中毒.
(1)“硫磺熏蒸”是应用二氧化硫的漂白性质,写出硫磺燃烧的化学方程式
(2)防止、减小毒筷“中毒”最简单的方法是用凉水清洗筷子表面,减少二氧化硫的含量.为研究SO2的溶解性质,某学生做如下实验:如右图,集气瓶中收集的是SO2,瓶塞系着瘪气球,向瓶中滴加紫色石蕊试液,实验现象是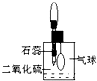 生取出瓶中溶液,将其滴入品红溶液,充分振荡,实验现象为
生取出瓶中溶液,将其滴入品红溶液,充分振荡,实验现象为
(3)在制一次性筷子时有“抛光”程序:加入滑石粉和木签一起搅拌,起到干燥、打磨的作用,使筷子变得光滑,以免毛疵划人的口腔.已知滑石粉是一种含水的具有层状结构的硅酸盐矿物.其质量组成为MgO 31.88%,SiO263.37%,H2O 4.75%,其化学式为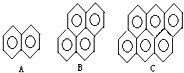
(4)有的厂家用石蜡代替“滑石粉抛光”,石蜡是含碳原子数(C20~C30)较多的稠环芳香烃,常温下为固体,温度高时熔化后可随食物进入人体致使慢性中毒.有如右的一系列物质,则A的分子式为
查看习题详情和答案>>
原料都是质地较好的木材,不用特殊加工.但是很多小作坊为了降低成本,使用劣质木材,为筷子看上去
白一些,他们常用硫磺进行熏蒸漂白,结果造成二氧化硫严重超标,同时硫磺中含铅、汞等重金属,也会
对人体造成铅中毒或汞中毒.
(1)“硫磺熏蒸”是应用二氧化硫的漂白性质,写出硫磺燃烧的化学方程式
S+O2
SO2
| ||
S+O2
SO2
| ||
(2)防止、减小毒筷“中毒”最简单的方法是用凉水清洗筷子表面,减少二氧化硫的含量.为研究SO2的溶解性质,某学生做如下实验:如右图,集气瓶中收集的是SO2,瓶塞系着瘪气球,向瓶中滴加紫色石蕊试液,实验现象是
紫色石蕊试液变红、气球鼓胀起来
紫色石蕊试液变红、气球鼓胀起来
;为比较SO2 和CO2溶解性的大小,某学生采取同样的装置和操作,能说明SO2在水中的溶解性大于CO2在水中溶解性的实验现象是SO2溶解时气球鼓胀的程度大于CO2溶解时气球的鼓胀程度
SO2溶解时气球鼓胀的程度大于CO2溶解时气球的鼓胀程度
.某学 生取出瓶中溶液,将其滴入品红溶液,充分振荡,实验现象为
生取出瓶中溶液,将其滴入品红溶液,充分振荡,实验现象为品红溶液的红色褪去(品红、SO2结合成不稳定的化合物),溶液显浅紫色(石蕊的颜色)
品红溶液的红色褪去(品红、SO2结合成不稳定的化合物),溶液显浅紫色(石蕊的颜色)
,接着向溶液中加入足量氯水,实验现象为 先变红后褪色(足量氯水能氧化SO2、石蕊和品红试液)
先变红后褪色(足量氯水能氧化SO2、石蕊和品红试液)
,再滴加BaCl2溶液,实验现象为生成白色沉淀(BaSO4)
生成白色沉淀(BaSO4)
.(3)在制一次性筷子时有“抛光”程序:加入滑石粉和木签一起搅拌,起到干燥、打磨的作用,使筷子变得光滑,以免毛疵划人的口腔.已知滑石粉是一种含水的具有层状结构的硅酸盐矿物.其质量组成为MgO 31.88%,SiO263.37%,H2O 4.75%,其化学式为
Mg3(Si4O10)(OH)2或3MgO?4SiO2?H2O
Mg3(Si4O10)(OH)2或3MgO?4SiO2?H2O
.
(4)有的厂家用石蜡代替“滑石粉抛光”,石蜡是含碳原子数(C20~C30)较多的稠环芳香烃,常温下为固体,温度高时熔化后可随食物进入人体致使慢性中毒.有如右的一系列物质,则A的分子式为
C10H8
C10H8
,A、B、C可以互称同系物吗?为什么?不能
不能
因为A、B、C相差n个C6H2,不是n个CH2
因为A、B、C相差n个C6H2,不是n个CH2
.该系列化合物里碳的最大质量分数为97.3%
97.3%
;若E是A的一个氢原子被羟基取代的产物,预测E可能具有哪些化学性质(至少举2条)E能与溴水发生取代反应、
E能与溴水发生取代反应、
E与FeCl3能发生显色反应、E能和碳酸钠溶液反应
E与FeCl3能发生显色反应、E能和碳酸钠溶液反应
.某学生做浓硫酸性质的实验:
实验一:在一个白色的点滴板的孔穴中分别放入小纸片、少量CuSO4?5H2O.然后如图1所示,分别滴入几滴浓硫酸,观察现象.回答下列问题:

(1)浓硫酸滴在小纸片上,小纸片变
(2)浓硫酸滴入CuSO4?5H2O中,胆矾
实验二:用如图2装置进行铜与一定体积已知浓度的浓硫酸反应的实验研究.
(1)写出试管B中的实验现象
(2)写出A处反应的化学方程式,并用双线桥标明电子转移的方向和数目:
 .
.
(3)充分反应后,该学生发现铜和硫酸都有剩余.在不补充浓硫酸的前提下,若要使剩余的铜片溶解,可再加入(要求填写一种与硫酸不同类别的物质)
(4)B试管口的棉花应沾有的试剂是
查看习题详情和答案>>
实验一:在一个白色的点滴板的孔穴中分别放入小纸片、少量CuSO4?5H2O.然后如图1所示,分别滴入几滴浓硫酸,观察现象.回答下列问题:

(1)浓硫酸滴在小纸片上,小纸片变
变黑
变黑
(填实验现象),说明浓硫酸具有脱水性
脱水性
性.(2)浓硫酸滴入CuSO4?5H2O中,胆矾
变为白色
变为白色
(填实验现象),说明浓硫酸具有吸水性
吸水性
性.实验二:用如图2装置进行铜与一定体积已知浓度的浓硫酸反应的实验研究.
(1)写出试管B中的实验现象
品红溶液褪色
品红溶液褪色
.(2)写出A处反应的化学方程式,并用双线桥标明电子转移的方向和数目:


(3)充分反应后,该学生发现铜和硫酸都有剩余.在不补充浓硫酸的前提下,若要使剩余的铜片溶解,可再加入(要求填写一种与硫酸不同类别的物质)
NaNO3、Fe2O3、FeCl3
NaNO3、Fe2O3、FeCl3
.(4)B试管口的棉花应沾有的试剂是
NaOH溶液
NaOH溶液
,其作用是吸收尾气,防止污染
吸收尾气,防止污染
,离子方程式为2OH-+SO2=SO32-+H2O
2OH-+SO2=SO32-+H2O
.