摘要:15.向含有lmdKAl(SO4)2的溶液中逐滴加入Ba(oH)2溶液.充分反应.下列说法不正确的是 A.当Al3+恰好完全沉淀时.消耗Ba(OH)21.5mol B.当SO2-4恰好完全沉淀时.Al3+全部转化为[AI(OH)4]- C.当向溶液中加入1.5molBa(OH)2时.反应可用下列离子方程式表示: 2A13++3SO+3Ba2++6OH-====2Al(OH)3↓+3BaSO4↑ D.随加入的Ba(OH)2的物质的量不断增大.沉淀的物质的量不断增大 第Ⅱ卷
网址:http://m.1010jiajiao.com/timu3_id_389419[举报]
硫酸盐在生产生活中有广泛应用.
Ⅰ.工业上以重晶石(主要成分BaSO4)为原料制备BaCl2,其工艺流程示意图如图1所示:

某研究小组查阅资料得:
BaSO4(s)+4C(s)
4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
BaSO4(s)+2C(s)
2CO2(g)+BaS(s)△H2=+226.2kJ?mol-1 ②
(1)用过量NaOH溶液吸收气体,得到硫化钠.该反应的离子方程式是
H2S+OH-
(2)反应C(s)+CO2(g)═2CO(g)的△H=
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的有两个
①从原料角度看,
②从能量角度看,①②为吸热反应,炭和氧气反应放热维持反应所需高温.
(4)该小组同学想对BaSO4在水中的沉淀溶解平衡做进一步研究,查资料发现在某温度时BaSO4在水中的沉淀溶解平衡曲线如图2所示.
该小组同学提出以下四种观点:
①当向含有SO42-的溶液中加入Ba2+使SO42-沉淀
完全,则此时SO42-在溶液中的浓度为0
②加入Na2SO4可以使溶液由a点变到b点
③通过蒸发可以使溶液由d点变到c点
④d点无BaSO4沉淀生成
其中正确的是
Ⅱ.某燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图3所示,电池总反应可表示为2H2+O2═2H2O.
请回答:
(5)H+由
(6)b极上发生的电极反应是
查看习题详情和答案>>
Ⅰ.工业上以重晶石(主要成分BaSO4)为原料制备BaCl2,其工艺流程示意图如图1所示:

某研究小组查阅资料得:
BaSO4(s)+4C(s)
| ||
BaSO4(s)+2C(s)
| ||
(1)用过量NaOH溶液吸收气体,得到硫化钠.该反应的离子方程式是
H2S+2OH-═2S2-+H2O
H2S+2OH-═2S2-+H2O
.S2-+H2O?HS-+OH-;HS-+H2O| 高温 |
(2)反应C(s)+CO2(g)═2CO(g)的△H=
+172.5 kJ?mol-1
+172.5 kJ?mol-1
.(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的有两个
①从原料角度看,
使BaSO4得到充分的还原,提高BaS的产量
使BaSO4得到充分的还原,提高BaS的产量
;②从能量角度看,①②为吸热反应,炭和氧气反应放热维持反应所需高温.
(4)该小组同学想对BaSO4在水中的沉淀溶解平衡做进一步研究,查资料发现在某温度时BaSO4在水中的沉淀溶解平衡曲线如图2所示.
该小组同学提出以下四种观点:
①当向含有SO42-的溶液中加入Ba2+使SO42-沉淀
完全,则此时SO42-在溶液中的浓度为0
②加入Na2SO4可以使溶液由a点变到b点
③通过蒸发可以使溶液由d点变到c点
④d点无BaSO4沉淀生成
其中正确的是
④
④
(填序号).Ⅱ.某燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图3所示,电池总反应可表示为2H2+O2═2H2O.
请回答:
(5)H+由
a
a
极通过固体酸电解质传递到另一极(填a或者b).(6)b极上发生的电极反应是
O2+4e-+4H+═2H2O
O2+4e-+4H+═2H2O
.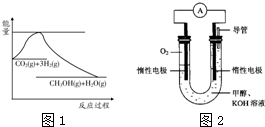 (2012?通州区一模)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:
(2012?通州区一模)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
(1)图1表示该反应过程中能量变化,则该反应为
放热
放热
反应(填“吸热”或“放热”),判断依据是反应物的总能量高于生成物的总能量
反应物的总能量高于生成物的总能量
;(2)某实验小组依据甲醇燃烧的反应原理,设计如图2所示的电池装置.
①该电池正极的电极反应式为:
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为:
2CH3OH+3O2+4KOH=2K2CO3+6H2O
2CH3OH+3O2+4KOH=2K2CO3+6H2O
;(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ∕mol
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ∕mol
;(4)为了消除污染,在一定条件下,向含有甲醇的废水中加入一定量的稀硝酸,会有N2等物质生成.若参加反应的氧化剂和还原剂的物质的量之比为6:5,写出该反应的化学方程式
5CH3OH+6HNO3=3N2↑+5CO2↑+13H2O
5CH3OH+6HNO3=3N2↑+5CO2↑+13H2O
;在此反应过程中若消耗32g 甲醇,将转移6
6
mol 电子.