网址:http://m.1010jiajiao.com/timu3_id_388839[举报]
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压力2.0~10.0Mpa,温度230~280℃)发生如下反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)二甲醚也可以通过天然气和CO2合成制得,该反应的化学方程式为
(2)催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=
(3)在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应②,测得反应达到平衡时的有关数据如下.
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CH3OCH3、1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 吸收a kJ | 放出b kJ | 放出c kJ |
| 平衡时体积(L) | V1 | V2 | V3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
A.a+2c=23.5 B.α1+α2=1 C.V1>V3 D.c1=2c3
(4)上述生产流程中,可以循环使用的物质有
Ⅱ.用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间纯Cu质量增加3.2g.

(5)请写出燃料电池中的负极反应式:
(6)燃料电池正极消耗标准状况下空气的体积是
(共16分) I.体积为5 L的恒温、恒容密闭容器甲起始投入2 mol N23 mol H2经过10s达平衡,测得平衡时NH3的物质的量为0.8 mol。
II.容器乙起始投入a mol N2,bmol H2,维持恒温、恒压到平衡,测得平衡时NH3的物质的量为1.2 mol。两平衡温度相同、相同组分的体积分数都相同。
(1)容器甲10 s 内用H2表示的平均反应速率v(H2)= _____,达平衡时N2的转化率 = ____。
(2)下列哪些情况表明容器乙已达平衡状态?( )
A.容器乙的气体密度不再变化 B.氢元素的质量不再变化
C.氮气的生成速率等于氨气的消耗速率 D.断裂1 mol N≡N键同时断裂6 mol N—H键
(3) 达平衡时甲容器的压强 乙容器的压强(填“等于”、“大于”或“小于”)。
(4) a = _______________mol,b= ______________mol。
(5) 达平衡时乙容器的体积为_____________L。
(6)起始时容器乙是容器甲压强的_______________倍。
查看习题详情和答案>>
(共16分) I.体积为5 L的恒温、恒容密闭容器甲起始投入2 mol N2 3 mol H2经过10s达平衡,测得平衡时NH3的物质的量为0.8 mol。
II.容器乙起始投入a mol N2,b mol H2,维持恒温、恒压到平衡,测得平衡时NH3的物质的量为1.2 mol。两平衡温度相同、相同组分的体积分数都相同。
(1)容器甲10 s 内用H2表示的平均反应速率v(H2) = _____,达平衡时N2的转化率 = ____。
(2)下列哪些情况表明容器乙已达平衡状态?( )
A.容器乙的气体密度不再变化 B.氢元素的质量不再变化
C.氮气的生成速率等于氨气的消耗速率 D.断裂1 mol N≡N键同时断裂6 mol N—H键
(3) 达平衡时甲容器的压强 乙容器的压强(填“等于”、“大于”或“小于”)。
(4) a = _______________mol,b = ______________mol。
(5) 达平衡时乙容器的体积为_____________L。
(6)起始时容器乙是容器甲压强的_______________倍。
查看习题详情和答案>>
(9分)工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)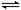 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是 。
A.向装置中充入O2 B.升高温度
C.向装置中充入N2 D.向装置中充入过量的SO2
(2)恒温恒压,通入3mol SO2和2mol O2 及固体催化剂,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g),下列说法正确的是
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
(3)500 ℃时将10 mol SO2和5.0 mol O2置于体积为1L的恒容密闭容器中,SO2转化为SO3的平衡转化率为0.95。则500℃时的平衡常数K= 。
(4)550 ℃,A、B表示不同压强下的平衡转化率(如图),通常工业生产中采用常压的原因是 ,
并比较不同压强下的平衡常数:K(0.10 MPa) K(1.0 MPa)。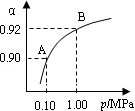
(共16分) I.体积为5 L的恒温、恒容密闭容器甲起始投入2 mol N2 3 mol H2经过10s达平衡,测得平衡时NH3的物质的量为0.8 mol。
II.容器乙起始投入a mol N2,b mol H2,维持恒温、恒压到平衡,测得平衡时NH3的物质的量为1.2 mol。两平衡温度相同、相同组分的体积分数都相同。
(1)容器甲10 s 内用H2表示的平均反应速率v(H2) = _____,达平衡时N2的转化率= ____。
(2)下列哪些情况表明容器乙已达平衡状态?( )
| A.容器乙的气体密度不再变化 | B.氢元素的质量不再变化 |
| C.氮气的生成速率等于氨气的消耗速率 | D.断裂1 mol N≡N键同时断裂6 mol N—H键 |
(4) a = _______________mol,b = ______________mol。
(5) 达平衡时乙容器的体积为_____________L。
(6)起始时容器乙是容器甲压强的_______________倍。 查看习题详情和答案>>