网址:http://m.1010jiajiao.com/timu3_id_388810[举报]
已知碱金属的氧化物有:普通氧化物,如Li2O;过氧化物,如Na2O2;超氧化物,如KO2;臭氧化物,如RbO3,其中后三者均能与H2O或CO2反应产生O2 。
(1)宇航工业,为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的探索,有的科学家提出了“金属过氧化物处理系统”。即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。每个宇航员平均每天需要消耗0.9 kg氧气,呼出1.0 kg二氧化碳。有关反应的化学方程式为 、 ;将处理后的气体充入座舱时,为了能保持飞船座舱内空气成分的稳定,还应采取的措施是___________________________________。
(2)人体内O2—离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式: O2— + H2O = H2O2+ O2+
(3)Na2O2、K2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是 (写电子式)
(4)高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则每个超氧化钾晶胞含有 个K+和 个O2-;该晶体中,0价氧原子与-2价氧原子的数目比为

查看习题详情和答案>>
已知碱金属的氧化物有:普通氧化物,如Li2O;过氧化物,如Na2O2;超氧化物,如KO2;臭氧化物,如RbO3,其中后三者均能与H2O或CO2反应产生O2 。
(1)宇航工业,为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的探索,有的科学家提出了“金属过氧化物处理系统”。即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。每个宇航员平均每天需要消耗0.9 kg氧气,呼出1.0 kg二氧化碳。有关反应的化学方程式为 、 ;将处理后的气体充入座舱时,为了能保持飞船座舱内空气成分的稳定,还应采取的措施是___________________________________。
(2)人体内O2—离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式: O2— + H2O = H2O2+ O2+
(3)Na2O2、K2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是 (写电子式)
(4)高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则每个超氧化钾晶胞含有 个K+和 个O2-;该晶体中,0价氧原子与-2价氧原子的数目比为
查看习题详情和答案>>
已知碱金属的氧化物有:普通氧化物,如Li2O;过氧化物,如Na2O2;超氧化物,如KO2;臭氧化物,如RbO3,其中后三者均能与H2O或CO2反应产生O2。
(1)宇航工业,为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的探索,有的科学家提出了“金属过氧化物处理系统”。即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。每个宇航员平均每天需要消耗0.9 kg氧气,呼出1.0 kg二氧化碳。有关反应的化学方程式为 、 ;将处理后的气体充入座舱时,为了能保持飞船座舱内空气成分的稳定,还应采取的措施是___________________________________。
(2)人体内O2—离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式: O2— + H2O = H2O2+ O2+
(3)Na2O2、K2O2、CaO2以及Ba O2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是 (写电子式)
O2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是 (写电子式)
(4)高温下,超氧化钾晶体 呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则每个超氧化钾晶胞含有 个K+和 个O2-;该晶体中,0价氧原子与-2价氧原子的数目比为
呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则每个超氧化钾晶胞含有 个K+和 个O2-;该晶体中,0价氧原子与-2价氧原子的数目比为 
(16分)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D 最外层电子数之比为2:3。试回答下列问题:
(1)A元素的名称是 ,E元素在周期表中的位置是 ;
(2)C、D、F的气态氢化物稳定性由强到弱的顺序是 (填化学式);
(3)E单质在足量D单质中燃烧生成的化合物的电子式是 ;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于 化合物(填“离子”或“共价”);
②X与Y的水溶液相混合发生反应的离子方程式为 ;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为: 。
(6)在A2D晶体中,每个分子与相邻的4个分子形成氢键,已知该晶体的升华热(晶体直接变成同温度气体时需要吸收的热量,叫做该晶体的升华热)是51 kJ/mol,除氢键外,分子间还存在范德华力(11 kJ/mol),则该晶体中氢键的“键能”是____kJ/mol;
【解析】原子核内无中子只有H,则A是氢元素。A和E,且E的原子序数大于B、C、D的,所以E只能是Na。B与D 最外层电子数之比为2:3,因为D的原子序数小于Na的所以D位于第二周期。若B与D 最外层电子数就是2和 3,则C就不能存在,所以B与D 最外层电子数就是4和6,即B是C,D是O,则C是N,F是S。
(1)略
(2)非金属性越强,氢化物的稳定性就越强,非金属性是O>N>S。
(3)钠的燃烧产物是过氧化钠,含有离子键和非极性键。
(4)钠是活泼的金属,所以由H、O、Na、S形成的化合物一定是离子化合物,它们分别为NaHSO4和NaHSO3。
(5)Na2S中S的化合价处于最低价态,具有还原性,而双氧水具有氧化性,二者分数氧化还原反应。
(6)每个水分子与相邻的4个分子形成氢键,则平均每个水分子形成的氢键是2个,所以氢键键能是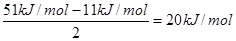 。
。
查看习题详情和答案>>
(16分)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D 最外层电子数之比为2:3。试回答下列问题:
(1)A元素的名称是 ,E元素在周期表中的位置是 ;
(2)C、D、F的气态氢化物稳定性由强到弱的顺序是 (填化学式);
(3)E单质在足量D单质中燃烧生成的化合物的电子式是 ;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于 化合物(填“离子”或“共价”);
②X与Y的水溶液相混合发生反应的离子方程式为 ;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为: 。
(6)在A2D晶体中,每个分子与相邻的4个分子形成氢键,已知该晶体的升华热(晶体直接变成同温度气体时需要吸收的热量,叫做该晶体的升华热)是51 kJ/mol,除氢键外,分子间还存在范德华力(11 kJ/mol),则该晶体中氢键的“键能”是____kJ/mol;
【解析】原子核内无中子只有H,则A是氢元素。A和E,且E的原子序数大于B、C、D的,所以E只能是Na。B与D 最外层电子数之比为2:3,因为D的原子序数小于Na的所以D位于第二周期。若B与D 最外层电子数就是2和 3,则C就不能存在,所以B与D 最外层电子数就是4和6,即B是C,D是O,则C是N,F是S。
(1)略
(2)非金属性越强,氢化物的稳定性就越强,非金属性是O>N>S。
(3)钠的燃烧产物是过氧化钠,含有离子键和非极性键。
(4)钠是活泼的金属,所以由H、O、Na、S形成的化合物一定是离子化合物,它们分别为NaHSO4和NaHSO3。
(5)Na2S中S的化合价处于最低价态,具有还原性,而双氧水具有氧化性,二者分数氧化还原反应。
(6)每个水分子与相邻的4个分子形成氢键,则平均每个水分子形成的氢键是2个,所以氢键键能是![]() 。
。
查看习题详情和答案>>