网址:http://m.1010jiajiao.com/timu3_id_388774[举报]
(1)写出这一过程发生反应的离子方程式
(2)加入Fe粉的过程中,溶液中Fe3+的物质的量n(Fe3+)随加入Fe粉的质量m(Fe)变化的曲线如甲图所示,请在乙图中画出n(Fe2+)随m(Fe)变化的曲线.
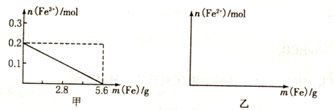
(3)当加入适量Fe粉,使溶液中n(Fe3+)=n(Fe2+)时,加入Fe粉的质量为
(1)写出这一过程发生反应的离子方程式________________________________。
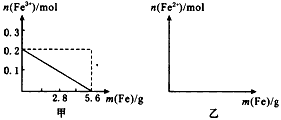
(2)加入Fe粉的过程中,溶液中Fe3+的物质的量n(Fe3+) 随加入Fe粉的质量m(Fe)变化的曲线如图甲所示。请在图乙画出n(Fe2+)随m(Fe)变化的曲线。
(1)甲同学认为是溶液中的Fe2+的干扰造成的,大家经过理性分析,认为可以排除Fe2+的干扰,理由是
(2)乙同学认为红色消失,说明Fe(SCN)3被破坏,红棕色NO2说明了某些离子与HNO3发生了氧化还原反应,推测可能是KSCN与HNO3作用.根据C、S、N的原子结构和共价键的相关知识推断SCN-的结构式为
(3)根据乙同学的,观点,设计了实验方案1,往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN溶液变为浅蓝色,最后变为无色.将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀.(此过程中溶液颜色变化不必细究),请写出向浓HNO3中滴入KSCN离子的方程式:
(4)丙同学认为SCN-的性质 还可进一步探究,设计了方案2,向Fe(SCN)3中分别滴加过量的氯水.溴水,溶液的红色均消失变为黄色,而加入过量的碘水时溶液的颜色基本不变.丙同学的设计意图是
(5)通过本次探究,可知用SCN-间接检验Fe2+时应注意
某实验小组利用饱和食盐水、导线、直流电源(用“” 或“
”表示)、烧杯、灵
敏电流计(用“”表示)和两个电极棒(分别是M、N)进行电化学实验探究。
甲同学安装好仪器,接好直流电源通电几分钟,发现M处溶液逐渐变浅绿色,过一段时间,溶液变得浑浊且逐渐出现红棕色。
乙同学所用的仪器和甲同学的看上去相同,但接好直流电源通电几秒钟,却闻到一股刺鼻的气味,马上停止通电。
丙同学安装好仪器,线路闭合几秒钟后,却没有发现明显现象产生,他又很快接入灵敏电流计,发现电流计的指针发生了偏转。
请根据上述同学的实验现象回答以下问题:
(1)M电极棒材料是(写化学式) ,N电极棒材料是(写化学式) 。
(2)在下列虚框内完成对应三个同学的装置图:
(3)按要求写出三个同学实验过程中涉及的反应方程式:
甲同学N电极方程式
乙同学总反应的离子方程式
丙同学N电极方程式
(4)用化学方程式解释甲同学实验时观察到M处溶液出现浑浊后转为红棕色现象的原因:
。
(5)丙同学为了保护M电极不被腐蚀,他可以将N电极棒更换为(写化学式) 。为验证该防护方法有效,他又做下列对比实验:接通电路2分钟后,分别在M电极区滴入2滴黄色K3[Fe(CN)6]溶液,发现没有更换N电极棒的烧杯中的现象是 。
查看习题详情和答案>>