网址:http://m.1010jiajiao.com/timu3_id_388743[举报]
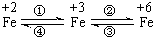 亚铁盐、铁盐、高铁酸盐等铁的重要化合物之间可以相互转化(见图).利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用于化学的定性或定量研究.
亚铁盐、铁盐、高铁酸盐等铁的重要化合物之间可以相互转化(见图).利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用于化学的定性或定量研究.已知FeO42-只能在强碱性介质中稳定存在,在酸性介质或水中不稳定:
4FeO42-+20H+═4Fe3++3O2↑+10H2O;4FeO42-+10H2O═4Fe(OH)3↓+3O2↑+8OH-
请利用下列用品:FeCl2溶液(浅绿色)、FeCl3溶液(黄色)、Na2FeO4溶液(紫红色)、铁粉、KSCN溶液、NaOH溶液、NaClO溶液、盐酸、氯水、蒸馏水及必要的实验仪器.完成下列任务:
(1)设计一个实现上述转化①(由FeCl2溶液制FeCl3固体)或④(由FeCl3溶液制FeCl2固体)的实验方案(要求产物纯净),你选择
(2)在浓碱中,用NaClO可以实现转化②,请完成这一反应的离子方程式:
3ClO-+2Fe(OH)3+
(3)一种新型高能碱性电池利用了转化③将化学能转化为电能.该电池由电解质(KOH水溶液)、K2FeO4、金属锌及必要的填充材料构成.请完成该电池放电时发生反应的化学方程式:2K2FeO4+
(4)高铁酸盐是比高锰酸盐更强的氧化剂,它还是一种“绿色、环保、高效”净水剂,具有很好的杀菌效果、形成絮凝物将水中的悬浮杂质除去.说它是“绿色环保高效”净水剂的原因是
| |||||||||||||||||||
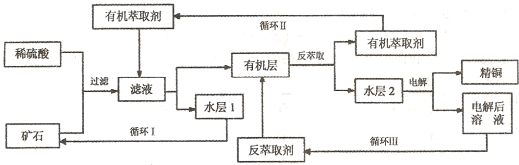
已知:①Cu2O+2H+=Cu2++Cu+H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液.回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体.若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式
(3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N一510、N一530等.某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH和n3个
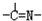 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=

(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式
(5)该工艺最大亮点是它符合下列原理
A.化学平衡 B.绿色化学 C.质量守恒 D.能量守恒 E.相似相溶 F.酸碱中和 G.氧化还原反应
(6)铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱币,因而有“货币金属”之称.由于铁的金属性比铜、银、金强,相对而言,人类认识铁稍晚.某研究性学习小组为了证明铁的金属活动性比铜强,他设计了如下方案:
①铁片置于硫酸铜溶液中有铜析出;
②铁、铜和氯气反应分别生成FeCl3和CuCl2;
③足量的铁粉和铜粉和浓硫酸反应生成FeSO4和CuSO4;
④铜片置于FeCl3溶液中铜片逐渐溶解;
⑤把铁片和铜片置于盛有稀硫酸的烧杯中,交用导线连接,铁片上无气泡产生,而铜片上有气泡产生;
⑥把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生.
以上设计合理的有
A.两种方案 B.三种方案 C.四种方案 D.五种方案.
水是生命之源,水处理工艺在生产生活中占有重要地位。自来水生产的流程示意图如下。(净水剂亦称混凝剂,常用的净水剂有聚合氯化铝、碱式氯化铝、硫酸亚铁、聚丙烯酰胺、聚合氯化铝铁、三氯化铁、聚合硫酸铁等)

(1)FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
(2)[A12(OH)nClm]是一种无机高分子的高价聚合电解质混凝剂,可视为介于三氯化铝和氢氧化铝之间的一种中间水解产物,则m与n之间的关系 ;
(3)推销净水器的商人用自来水做电解实验,装置如图。一段时间后,两极间产生白色沉淀,并很快变成红褐色,然后用净水器净化后的水做电解实验;两极上只有气体产生,水中并无沉淀,以此来说明自来水很“脏”。则沉淀变成红褐色时所发生的化学反应方程式为: 。

(4)MnSO4是水质检测中的一种常用试剂
①MnSO4和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸盐及另外一种产物,写出并配平上述反应的化学方程式: 。
②水中的溶解氧测定过程为:取水样,迅速加入MnSO4和KOH混合液,再加入KI溶液,立即塞好塞子,振荡使完全反应(反应为:Mn2++O2+H2O→MnOOH,未配平)。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。则该离子反应方程式: 。用Na2S2O3溶液滴定生成的碘,根据消耗溶液的体积可计算出水中溶解氧的量。
查看习题详情和答案>>
水是生命之源,水处理工艺在生产生活中占有重要地位。自来水生产的流程示意图如下。(净水剂亦称混凝剂,常用的净水剂有聚合氯化铝、碱式氯化铝、硫酸亚铁、聚丙烯酰胺、聚合氯化铝铁、三氯化铁、聚合硫酸铁等)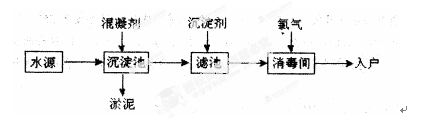
(1)FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
(2)[A12(OH)nClm]是一种无机高分子的高价聚合电解质混凝剂,可视为介于三氯化铝和氢氧化铝之间的一种中间水解产物,则m与n之间的关系 ;
(3)推销净水器的商人用自来水做电解实验,装置如图。一段时间后,两极间产生白色沉淀,并很快变成红褐色,然后用净水器净化后的水做电解实验;两极上只有气体产生,水中并无沉淀,以此来说明自来水很“脏”。则沉淀变成红褐色时所发生的化学反应方程式为: 。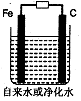
(4)MnSO4是水质检测中的一种常用试剂
①MnSO4和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸盐及另外一种产物,写出并配平上述反应的化学方程式: 。
②水中的溶解氧测定过程为:取水样,迅速加入MnSO4和KOH混合液,再加入KI溶液,立即塞好塞子,振荡使完全反应(反应为:Mn2++O2+H2O→MnOOH,未配平)。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。则该离子反应方程式: 。用Na2S2O3溶液滴定生成的碘,根据消耗溶液的体积可计算出水中溶解氧的量。