摘要:18.反应 A+B == C 的反应速率方程式为:v = k c (A) c (B).v为反应速率.k为速率常数.当c (A) = c (B) = 1mol/L时.反应速率在数值上等于速率常数.下列说法正确的是 A.只增大c (A)时.v值增大 B.只增大c (C)时.v值增大 C.只升高温度时.k值不变 D.只升高温度时.k值变小
网址:http://m.1010jiajiao.com/timu3_id_38868[举报]
反应 A+B → C 的反应速率方程式为:v = kc (A) c (B), v为反应速率, k为速率常数。当c (A) = c (B) = 1mol/L时,反应速率在数值上等于速率常数。下列说法正确的是
- A.只增大c (A)时,v也增大
- B.只增大c (A)时,v值不变
- C.只升高温度时,k值不变
- D.只升高温度时,k值变小
反应A+BC的反应速率方程式为:v=k?c(A)?c(B),v为反应速率,k为速率常数。当c(A)=c(B)=1 mol/L时,反应速率在数值上等于速率常数。下列说法正确的是( )
A.c(A)增大时,v也增大 B.c(B)增大时,k也增大
C.升高温度时,k值不变 D.升高温度时,v值增大
查看习题详情和答案>>化学反应原理在工业生产中具有十分重要的意义.
(1)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如图:
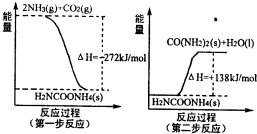
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为 .
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=akJ.mol-1.测得在不同温度下,该反应的平衡常数K随温度的变化如下:
①该反应的化学平衡常数表达式K= ,a 0(填“>”、“<”或“=”).在500℃2L密闭容器中进行反应,Fe和CO2的起始量均为4mol,则5min后达到平衡时CO2的转化率为
,生成CO的平均速率v(CO)为 .
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填字母).
A.缩小反应器容积 B.增加Fe的物质的量
C.升高温度到900℃D.使用合适的催化剂
(3)硫酸厂常用NaOH溶液吸收SO2废气.当吸收液呈中性时,溶液中离子浓度关系正确的是[已知n(SO
):n(HSO
)=1:1时,pH=7.2](填字母) .
A、c(Na+)=2c(SO
)+c(HSO
)
B、c(Na+)>c(HSO
)>c(SO
)>c(H+)=c(OH-)
C、c(Na+)+c(H+)=c(SO
)+c(HSO
)+c(OH-)
查看习题详情和答案>>
(1)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如图:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=akJ.mol-1.测得在不同温度下,该反应的平衡常数K随温度的变化如下:
| 温度/ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有
A.缩小反应器容积 B.增加Fe的物质的量
C.升高温度到900℃D.使用合适的催化剂
(3)硫酸厂常用NaOH溶液吸收SO2废气.当吸收液呈中性时,溶液中离子浓度关系正确的是[已知n(SO
2- 3 |
- 3 |
A、c(Na+)=2c(SO
2- 3 |
- 3 |
B、c(Na+)>c(HSO
- 3 |
2- 3 |
C、c(Na+)+c(H+)=c(SO
2- 3 |
- 3 |
化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下:
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为 。
(2)已知反应Fe(s) +CO2(g)  FeO(s) +CO(g) ΔH ="a" kJ/mol
FeO(s) +CO(g) ΔH ="a" kJ/mol
测得在不同温度下,该反应的平衡常数K随温度的变化如下:
①该反应的化学平衡常数表达式K= ,a 0(填“>”、“<”或“=”)。在500℃ 2L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为 ,生成CO的平均速率v(CO)为 。
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有
(填字母)。
| A.缩小反应器容积 | B.增加Fe的物质的量 |
| C.升高温度到900℃ | D.使用合适的催化剂 |
化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为 。
(2)已知反应Fe(s) +CO2(g) FeO(s) +CO(g) ΔH ="a" kJ/mol
FeO(s) +CO(g) ΔH ="a" kJ/mol
测得在不同温度下,该反应的平衡常数K随温度的变化如下:

①该反应的化学平衡常数表达式K= ,a 0(填“>”、“<”或“=”)。在500℃ 2L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为 ,生成CO的平均速率v(CO)为 。
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有
(填字母)。
(1)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为 。
(2)已知反应Fe(s) +CO2(g)
 FeO(s) +CO(g) ΔH ="a" kJ/mol
FeO(s) +CO(g) ΔH ="a" kJ/mol 测得在不同温度下,该反应的平衡常数K随温度的变化如下:

①该反应的化学平衡常数表达式K= ,a 0(填“>”、“<”或“=”)。在500℃ 2L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为 ,生成CO的平均速率v(CO)为 。
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有
(填字母)。
| A.缩小反应器容积 | B.增加Fe的物质的量 |
| C.升高温度到900℃ | D.使用合适的催化剂 |