网址:http://m.1010jiajiao.com/timu3_id_387857[举报]
(07年重庆卷)(16分)某兴趣小组设计出题27图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
 (1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸。c中反应的化学方程式是_____ 。再由a向c中加2 mL蒸馏水,c中的实验现象是__________ 。
(3)题27表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是________ 。理由是_____________。
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2。操作步骤为 ,实验现象为 ;但此实验的不足之处是 。

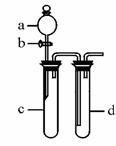
(固定装置略去)
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是 。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是 。再由a向c中加2 mL蒸馏水,c中的实验现象是 。
(3)题27表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 。理由是______________ 。
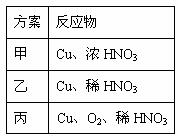
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2。操作步骤为 ,实验现象为 ;但此实验的不足之处是 。
查看习题详情和答案>>