摘要:125kg泡菜含m(NaNO2)=2.76 g·kg-1×0.125 kg =0.345g 345mg>300mg.会引起中毒
网址:http://m.1010jiajiao.com/timu3_id_387800[举报]
物质的量浓度为a mol?L-1的Na2SO4溶液,若含m g钠离子时,其溶液的体积是
mL;若该硫酸钠溶液中溶质的质量分数为b%,则此Na2SO4溶液的密度是
g?mL-1.
查看习题详情和答案>>
| 1000m |
| 46a |
| 1000m |
| 46a |
| 142a |
| 10b |
| 142a |
| 10b |
(2011?厦门一模)某化学兴趣小组用如图装置模拟工业制备造纸原料BaSO3,并测定产品纯度.
(1)图1烧瓶中发生反应的化学方程式为
(2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有①BaSO3、②
实验一:探究白色沉淀的成分
(3)设计如下实验方案:
实验二:测定产品纯度
(4)取白色沉淀wg于图2装置的试管,在分液漏斗中加入
×100%
×100%(用含m、w的式子表示).本测定方案有缺陷,请指出本方案的缺点及其对实验结果的可能影响.
答:
(5)为制备纯净的BaSO3,请设计改进图1装置的实验方案.
答:
查看习题详情和答案>>

(1)图1烧瓶中发生反应的化学方程式为
Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O
Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O
; (2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有①BaSO3、②
BaSO4
BaSO4
;实验一:探究白色沉淀的成分
(3)设计如下实验方案:
| 实验步骤 | 预期现象与结论 |
| 步骤1:用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液 | 白色沉淀不溶解,溶液呈红色. |
| 步骤2:往上述试管中滴加足量 稀盐酸 稀盐酸 ,充分振荡. |
若 沉淀部分溶解 沉淀部分溶解 ,则含有②. |
(4)取白色沉淀wg于图2装置的试管,在分液漏斗中加入
稀硫酸
稀硫酸
(可从稀盐酸、稀硝酸、稀NaOH溶液中选择一种).实验后,测得C装置增重mg,根据此实验数据可计算出白色沉淀中BaSO3的质量分数为| 217m |
| 64w |
| 217m |
| 64w |
答:
选用盐酸溶解沉淀,因为盐酸挥发出氯化氢气体被C吸收后可以导致结果偏大;二氧化硫未被完全吸收可能导致结果偏小
选用盐酸溶解沉淀,因为盐酸挥发出氯化氢气体被C吸收后可以导致结果偏大;二氧化硫未被完全吸收可能导致结果偏小
;(5)为制备纯净的BaSO3,请设计改进图1装置的实验方案.
答:
先从烧瓶的左边通入氮气排除这种中的空气
先从烧瓶的左边通入氮气排除这种中的空气
.明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质.具体实验步骤如图所示:

根据上述图示,完成下列天空:
(1)明矾石焙烧后用稀氨水浸出.配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有250.28g氨) mL,用规格为 mL量筒量取.
(2)氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+.检验NH4+的方法是 .
(3)写出沉淀物中所有物质的化学式 .
(4)滤液I的成分是水和 .
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量 溶液,产生白色沉淀.
② 、 、 (依次填写实验操作名称).
③冷却、称重.
(6)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为: mol(用含m、n的代数式表示).
查看习题详情和答案>>

根据上述图示,完成下列天空:
(1)明矾石焙烧后用稀氨水浸出.配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有250.28g氨)
(2)氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+.检验NH4+的方法是
(3)写出沉淀物中所有物质的化学式
(4)滤液I的成分是水和
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量
②
③冷却、称重.
(6)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:
 (2012?朝阳区二模)氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3?6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):
(2012?朝阳区二模)氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3?6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):操作步骤如下:
Ⅰ.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1、打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeCl3?6H2O晶体.请回答:
(1)A中发生的置换反应的化学方程式是
Fe+2HCl=FeCl2+H2
Fe+2HCl=FeCl2+H2
.(2)操作Ⅱ中“…”的内容是
当A中固体完全消失
当A中固体完全消失
,烧杯中的现象是无色溶液逐渐变黄
无色溶液逐渐变黄
,相应的离子方程式和化学方程式是2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
、2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(3)操作Ⅲ不采用直接加热制FeCl3?6H2O晶体的原因是
Fe3++3H2O?Fe(OH)3+3H+,加热会促进FeCl3水解,产生Fe(OH)3
Fe3++3H2O?Fe(OH)3+3H+,加热会促进FeCl3水解,产生Fe(OH)3
(用简要文字并结合离子方程式解释).(4)测得B中所得的气体是V mL(标准状况时),由此计算出该废铁屑中铁的质量分数是
| V |
| 400m |
Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少
Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少
.(5)为了准确测定铁的质量分数,还可以另取mg废铁屑和某种常见的还原剂气体在加热时充分反应到恒重,测得实验后剩余固体质量是wg.由此求出铁的准确质量分数是
m-
| ||
| m |
m-
| ||
| m |
某链状有机物分子中含m个-CH3,n个-CH2-,a个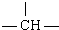 ,其余为羟基(-OH),则羟基(-OH)的数目可能是( )
,其余为羟基(-OH),则羟基(-OH)的数目可能是( )
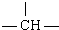 ,其余为羟基(-OH),则羟基(-OH)的数目可能是( )
,其余为羟基(-OH),则羟基(-OH)的数目可能是( )| A、2n+3a-m | B、a+2-m | C、n+m+a | D、a+2n+2-m |