摘要:22.甲.乙.丙.丁为前三周期元素形成的微粒.它们的电子总数相等.已知甲.乙为双原子分子.丙为负二价阴离子.丁为原子.它的最外层电子数是其次外层电子数的一半. (1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体.反应的化学方程式 (2)乙在高温时是一种还原剂.请用化学方程式表示它在工业上的一种重要用途: (3)在一定条件下.甲与O2反应的化学方程式是 (4)丁的元素符号是 .其原子结构示意图为 (5)丁的氧化物的晶体结构与 的晶体结构相似.
网址:http://m.1010jiajiao.com/timu3_id_387653[举报]
 甲、乙、丙、丁是由前20号元素组成的物质,有如下转化:甲+乙→丙+丁
甲、乙、丙、丁是由前20号元素组成的物质,有如下转化:甲+乙→丙+丁
(1)若甲为块状固体,丙为分子内同时具有极性键和非极性键可燃性气体,乙为水,则丙的结构式______.
(2)若甲和丁是同主族元素组成的单质,乙为水.且甲的组成元素位于第三周期,反应的离子方程式______.
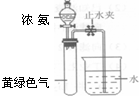
(3)霍夫曼根据上述反应,用右图实验装置测定了氨分子的组成.打开分液漏斗活塞,滴下浓氨水至不再反应为止;关闭活塞,待恢复至室温,打开止水夹,试管内液面上升至2/3处.①滴加浓氨水后试管内的现象______②相应的反应化学方程式______
(4)若甲Cl2,乙为NH4Cl反应,丁为HCl,丙为氮的氯化物,当消耗6.72L Cl2(标状)时得到0.10mol氮的氯化物,丙的化学式______,反应方程式______
(5)某短周期金属元素的单质与核电荷数为其2倍的金属元素的氧化物之间也能发生上述反应,请写出相应的化学方程式______.
查看习题详情和答案>>
甲、乙、丙、丁是由前20号元素组成的物质,有如下转化:甲+乙→丙+丁
(1)若甲为块状固体,丙为分子内同时具有极性键和非极性键可燃性气体,乙为水,则丙的结构式______.
(2)若甲和丁是同主族元素组成的单质,乙为水.且甲的组成元素位于第三周期,反应的离子方程式______.
(3)霍夫曼根据上述反应,用右图实验装置测定了氨分子的组成.打开分液漏斗活塞,滴下浓氨水至不再反应为止;关闭活塞,待恢复至室温,打开止水夹,试管内液面上升至2/3处.①滴加浓氨水后试管内的现象______②相应的反应化学方程式______
(4)若甲Cl2,乙为NH4Cl反应,丁为HCl,丙为氮的氯化物,当消耗6.72L Cl2(标状)时得到0.10mol氮的氯化物,丙的化学式______,反应方程式______
(5)某短周期金属元素的单质与核电荷数为其2倍的金属元素的氧化物之间也能发生上述反应,请写出相应的化学方程式______.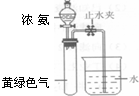
查看习题详情和答案>>
(1)若甲为块状固体,丙为分子内同时具有极性键和非极性键可燃性气体,乙为水,则丙的结构式______.
(2)若甲和丁是同主族元素组成的单质,乙为水.且甲的组成元素位于第三周期,反应的离子方程式______.
(3)霍夫曼根据上述反应,用右图实验装置测定了氨分子的组成.打开分液漏斗活塞,滴下浓氨水至不再反应为止;关闭活塞,待恢复至室温,打开止水夹,试管内液面上升至2/3处.①滴加浓氨水后试管内的现象______②相应的反应化学方程式______
(4)若甲Cl2,乙为NH4Cl反应,丁为HCl,丙为氮的氯化物,当消耗6.72L Cl2(标状)时得到0.10mol氮的氯化物,丙的化学式______,反应方程式______
(5)某短周期金属元素的单质与核电荷数为其2倍的金属元素的氧化物之间也能发生上述反应,请写出相应的化学方程式______.

甲、乙、丙、丁是由前20号元素组成的物质,有如下转化:甲+乙→丙+丁
(1)若甲为块状固体,丙为分子内同时具有极性键和非极性键可燃性气体,乙为水,则丙的结构式 .
(2)若甲和丁是同主族元素组成的单质,乙为水.且甲的组成元素位于第三周期,反应的离子方程式 .
(3)霍夫曼根据上述反应,用右图实验装置测定了氨分子的组成.打开分液漏斗活塞,滴下浓氨水至不再反应为止;关闭活塞,待恢复至室温,打开止水夹,试管内液面上升至2/3处.①滴加浓氨水后试管内的现象 ②相应的反应化学方程式
(4)若甲Cl2,乙为NH4Cl反应,丁为HCl,丙为氮的氯化物,当消耗6.72L Cl2(标状)时得到0.10mol氮的氯化物,丙的化学式 ,反应方程式
(5)某短周期金属元素的单质与核电荷数为其2倍的金属元素的氧化物之间也能发生上述反应,请写出相应的化学方程式 .
 查看习题详情和答案>>
查看习题详情和答案>>
(1)若甲为块状固体,丙为分子内同时具有极性键和非极性键可燃性气体,乙为水,则丙的结构式 .
(2)若甲和丁是同主族元素组成的单质,乙为水.且甲的组成元素位于第三周期,反应的离子方程式 .
(3)霍夫曼根据上述反应,用右图实验装置测定了氨分子的组成.打开分液漏斗活塞,滴下浓氨水至不再反应为止;关闭活塞,待恢复至室温,打开止水夹,试管内液面上升至2/3处.①滴加浓氨水后试管内的现象 ②相应的反应化学方程式
(4)若甲Cl2,乙为NH4Cl反应,丁为HCl,丙为氮的氯化物,当消耗6.72L Cl2(标状)时得到0.10mol氮的氯化物,丙的化学式 ,反应方程式
(5)某短周期金属元素的单质与核电荷数为其2倍的金属元素的氧化物之间也能发生上述反应,请写出相应的化学方程式 .
 查看习题详情和答案>>
查看习题详情和答案>>
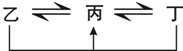 有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系:
有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系:①均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;
②均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
请回答下列问题:
(1)化合物甲的电子式为
(2)F元素在周期表中的位置
(3)均含有D元素的乙与丁在溶液中发生反应的离子方程式
(4)丙、丁分别是含F元素的简单阳离子,检验含丙、丁两种离子的混合溶液中的低价离子,可以用酸性KMnO4溶液,其对应的离子方程式为:
(5)已知常温下化合物FE的Ksp=6×10-18 mol2?L-2,常温下将1.0×10-5mol?L-1的Na2E溶液与含FSO4溶液按体积比3:2混合,若有沉淀FE生成,则所需的FSO4的浓度要求
(12分)有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属。A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族。下图中均含D或F元素的物质均会有图示转化关系:
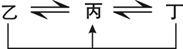
①均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;
②均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应。请回答下列问题:
(1)化合物甲的电子式为 。
(2)F元素在周期表中的位置 ;稳定性:A2C A2E(填“大于”“小于” “等于”)。
(3)均含有D元素的乙与丁在溶液中发生反应的离子方程式 。
(4)丙、丁分别是含F元素的简单阳离子,检验含丙、丁两种离子的混合溶液中的低价离子,可以用酸性KMnO4溶液,其对应的离子方程式为:
(5)已知常温下化合物FE的Ksp=6×10-18 mol2·L-2,常温下将1.0×10-5mol·L-1的Na2E溶液与含FSO4溶液按体积比3 :2混合,若有沉淀F E生成,则所需的FSO4的浓度要求 。(忽略混合后溶液的体积变化)。
查看习题详情和答案>>