摘要:48.大气中二氧化碳增加的原因有 . 等. [答案]绿色植物减少.汽车排放尾气.森林大火.工厂排放大量二氧化碳.
网址:http://m.1010jiajiao.com/timu3_id_387627[举报]
简要回答下列问题
(1)大气中二氧化碳的含量会引起“温度效应”,为防止“温室效应”增强,人类应采取的措施是
(2)居室装修完毕,通常要开窗通风一段时间后才能入住,其原因是
(3)医院常用酒精、苯酚等消毒、杀菌,请说明理由.
查看习题详情和答案>>
(1)大气中二氧化碳的含量会引起“温度效应”,为防止“温室效应”增强,人类应采取的措施是
少用化石燃料;限制CO2的排放;开发新能源;保护地球上的森林资源;增加城市的绿地面积等等
少用化石燃料;限制CO2的排放;开发新能源;保护地球上的森林资源;增加城市的绿地面积等等
(只要求谈一点即可)(2)居室装修完毕,通常要开窗通风一段时间后才能入住,其原因是
居室装修完毕,室内留有大量对人体有害的挥发性物质如甲醛、苯等,所以通常要开窗通风一段时间后才能入住
居室装修完毕,室内留有大量对人体有害的挥发性物质如甲醛、苯等,所以通常要开窗通风一段时间后才能入住
(3)医院常用酒精、苯酚等消毒、杀菌,请说明理由.
酒精、苯酚等可使细菌中蛋白质变性
酒精、苯酚等可使细菌中蛋白质变性
.(13分)近些年来,世界各地频现种种极端天气。二氧化碳、氮氧化物、二氧化硫等是导致极端天气的重要因素,研究这些化合物的综合处理具有重要意义。
(1)工业上可利用二氧化碳和氨气合成尿素,其总反应如下:
2NH3(g)+CO2(g)  CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) 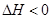 ,该反应在 (填“较高温度”或“较低温度”)下能自发进行。
,该反应在 (填“较高温度”或“较低温度”)下能自发进行。
(2)已知合成尿素分两步进行:
第1步:2NH3(g)+CO2(g) NH2COONH4(s)
NH2COONH4(s) 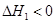
第2步:NH2COONH4(s) CO(NH2)2(l)+ H2O(l)
CO(NH2)2(l)+ H2O(l) 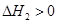
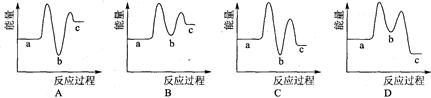
下列示意图中[a表示2NH3(g)+ CO2(g),b表示NH2COONH4(S),c表示CO(NH2)2(l)+ H2O(l)],能正确表示尿素合成过程中能量变化曲线的是(填序号) 。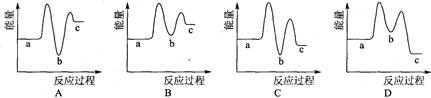
(3)合成尿素过程中,当NH3与CO2的物质的量之比为1:2时,NH3
的转化率随时间的变化关系如图所示。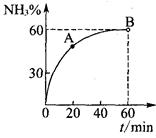
①A点的逆反应速率v逆(CO2) B点的逆反应速率
v逆 (CO2)(填“﹤”“﹥”或“=”)。
②达到平衡时,CO2的转化率为 。
(4)活性炭可用于处理大气污染物NO,在某1L恒容密闭容器中加入 0.100molNO 和2.030mol固体活性炭(无杂质),生成气体E和气体F。当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
 物质 物质n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应在T1℃时的平衡常数为K1,在T2℃时的平衡常数为K2。计算K1= ,根据题给信息判断,T1和T2的关系是 。
A. T1>T2 B. T1<T2 C.无法比较
③若密闭容器为容积可变,根据化学反应原理,分析增加压强对该反应的影响
。 查看习题详情和答案>>
(13分)近些年来,世界各地频现种种极端天气。二氧化碳、氮氧化物、二氧化硫等是导致极端天气的重要因素,研究这些化合物的综合处理具有重要意义。
(1)工业上可利用二氧化碳和氨气合成尿素,其总反应如下:
2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)  ,该反应在 (填“较高温度”或“较低温度”)下能自发进行。
,该反应在 (填“较高温度”或“较低温度”)下能自发进行。
(2)已知合成尿素分两步进行:
第1步:2NH3(g)+CO2(g) NH2COONH4(s)
NH2COONH4(s) 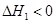
第2步:NH2COONH4(s) CO(NH2)2(l)+ H2O(l)
CO(NH2)2(l)+ H2O(l) 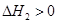
下列示意图中[a表示2NH3(g)+ CO2(g),b表示NH2COONH4(S),c表示CO(NH2)2(l)+ H2O(l)],能正确表示尿素合成过程中能量变化曲线的是(填序号) 。
(3)合成尿素过程中,当NH3与CO2的物质的量之比为1:2时,NH3
的转化率随时间的变化关系如图所示。
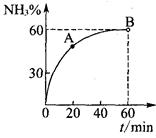
①A点的逆反应速率v逆(CO2) B点的逆反应速率
v逆 (CO2)(填“﹤”“﹥”或“=”)。
②达到平衡时,CO2的转化率为 。
(4)活性炭可用于处理大气污染物NO,在某1L恒容密闭容器中加入 0.100molNO 和2.030mol固体活性炭(无杂质),生成气体E和气体F。当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
①请结合上表数据,写出NO与活性炭反应的化学方程式 。
②上述反应在T1℃时的平衡常数为K1,在T2℃时的平衡常数为K2。计算K1= ,根据题给信息判断,T1和T2的关系是 。
A. T1>T2 B. T1<T2 C.无法比较
③若密闭容器为容积可变,根据化学反应原理,分析增加压强对该反应的影响
。
(1)工业上可利用二氧化碳和氨气合成尿素,其总反应如下:
2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)  ,该反应在 (填“较高温度”或“较低温度”)下能自发进行。
,该反应在 (填“较高温度”或“较低温度”)下能自发进行。(2)已知合成尿素分两步进行:
第1步:2NH3(g)+CO2(g)
 NH2COONH4(s)
NH2COONH4(s) 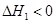
第2步:NH2COONH4(s)
 CO(NH2)2(l)+ H2O(l)
CO(NH2)2(l)+ H2O(l) 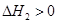
下列示意图中[a表示2NH3(g)+ CO2(g),b表示NH2COONH4(S),c表示CO(NH2)2(l)+ H2O(l)],能正确表示尿素合成过程中能量变化曲线的是(填序号) 。

(3)合成尿素过程中,当NH3与CO2的物质的量之比为1:2时,NH3
的转化率随时间的变化关系如图所示。

①A点的逆反应速率v逆(CO2) B点的逆反应速率
v逆 (CO2)(填“﹤”“﹥”或“=”)。
②达到平衡时,CO2的转化率为 。
(4)活性炭可用于处理大气污染物NO,在某1L恒容密闭容器中加入 0.100molNO 和2.030mol固体活性炭(无杂质),生成气体E和气体F。当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
 物质 物质n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应在T1℃时的平衡常数为K1,在T2℃时的平衡常数为K2。计算K1= ,根据题给信息判断,T1和T2的关系是 。
A. T1>T2 B. T1<T2 C.无法比较
③若密闭容器为容积可变,根据化学反应原理,分析增加压强对该反应的影响
。
随着人类的发展,氮氧化物(NOx)已成为大气中的主要污染物之一
(1)超音速飞机排放的尾气是平流层中NOx的主要来源它们破坏臭氧层的机理是:
上述反应的总反应式为_____________,其中 _____________是催化剂。
(2)汽车尾气中含有NOx、CO和碳氢化合物等。
①汽车尾气净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。尾气净化装置中发生的总反应化学方程式为_________________。
(1)超音速飞机排放的尾气是平流层中NOx的主要来源它们破坏臭氧层的机理是:

上述反应的总反应式为_____________,其中 _____________是催化剂。
(2)汽车尾气中含有NOx、CO和碳氢化合物等。
①汽车尾气净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。尾气净化装置中发生的总反应化学方程式为_________________。

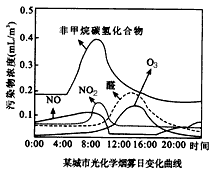
②NOx和碳氢化合物在阳光照射下发生光化学反应产生二次污染物的现象,称为“光化学烟雾”。有学者对某城市一天中光化学烟雾的变化情况进行测定,实验结果如下图所示。由图像可知,二次污染物有_______________等,醛和O3的峰值出现在14:00左右的主要原因是__________________。
(3)硝酸工业尾气中的NOx可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3 = NaNO2+NaNO3+CO2 ,NO+NO2+Na2CO3 =2NaNO2+CO2
现用0.5 L 2 mol/L的纯碱溶液恰好吸收一定量硝酸工业尾气中的NOx,吸收液质量增加44 g(设CO2全部排出)。则NO2和NO的体积比为___________。
查看习题详情和答案>>
现用0.5 L 2 mol/L的纯碱溶液恰好吸收一定量硝酸工业尾气中的NOx,吸收液质量增加44 g(设CO2全部排出)。则NO2和NO的体积比为___________。
随着人类社会的发展,氮氧化物(NOx)已成为大气中的主要气态污染物之一。
(1)超音速飞机排放的尾气是平流层中NOx的主要来源。它们破坏臭氧层的机理为:
①O3 O+O2 ②NO+O3→NO2+O2 ③NO2+O→NO+O2
O+O2 ②NO+O3→NO2+O2 ③NO2+O→NO+O2
上述反应的总反应式为____________________,其中________是催化剂。
(2)汽车尾气中含有NOx、CO和碳氢化合物等。
①汽车尾气净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示
(1)超音速飞机排放的尾气是平流层中NOx的主要来源。它们破坏臭氧层的机理为:
①O3
 O+O2 ②NO+O3→NO2+O2 ③NO2+O→NO+O2
O+O2 ②NO+O3→NO2+O2 ③NO2+O→NO+O2 上述反应的总反应式为____________________,其中________是催化剂。
(2)汽车尾气中含有NOx、CO和碳氢化合物等。
①汽车尾气净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示

尾气净化装置中发生的总反应的化学方程式为________________。
②NOx和碳氢化合物在阳光照射下发生光化学反应产生二次污染物的现象,称为“光化学烟雾”。有学者对某城市一天中光化学烟雾的变化情况进行测定,实验结果如图所示。由图象可知,二次污染物有
________等,醛和O3的峰值出现在14∶00左右的主要原因是__________________________。
②NOx和碳氢化合物在阳光照射下发生光化学反应产生二次污染物的现象,称为“光化学烟雾”。有学者对某城市一天中光化学烟雾的变化情况进行测定,实验结果如图所示。由图象可知,二次污染物有
________等,醛和O3的峰值出现在14∶00左右的主要原因是__________________________。

③测定汽车尾气中NOx的方法之一是用3%的H2O2溶液吸收尾气中的NOx生成HNO3,再用NaOH标准溶液滴定HNO3。若要测定标准状况下尾气中NOx的体积分数,所需的数据有________(选填序号)。
A.所测尾气的总体积
B.两种氮氧化物的体积比
C.NaOH标准溶液的物质的量浓度
D.所消耗NaOH标准溶液的体积
E.从滴定开始到指示剂变色所需的时间
(3)硝酸工业尾气中的NOx可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3==NaNO2+NaNO3+CO2
NO+NO2+Na2CO3==2NaNO2+CO2
现用0.5 L 2 mol/L的纯碱溶液恰好吸收一定量硝酸工业尾气中的NOx,吸收液质量增加44 g(设CO2全部排出)。则NO2和NO的体积比为________。
查看习题详情和答案>>
A.所测尾气的总体积
B.两种氮氧化物的体积比
C.NaOH标准溶液的物质的量浓度
D.所消耗NaOH标准溶液的体积
E.从滴定开始到指示剂变色所需的时间
(3)硝酸工业尾气中的NOx可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3==NaNO2+NaNO3+CO2
NO+NO2+Na2CO3==2NaNO2+CO2
现用0.5 L 2 mol/L的纯碱溶液恰好吸收一定量硝酸工业尾气中的NOx,吸收液质量增加44 g(设CO2全部排出)。则NO2和NO的体积比为________。