网址:http://m.1010jiajiao.com/timu3_id_386885[举报]
在一定条件下进行下列可逆反应的实验:
A(g)+2B(g) ![]() 3C(g);△H<0平行三组实验的有关条件如下表:
3C(g);△H<0平行三组实验的有关条件如下表:
| 反应组别 | 温度 | 容器体积 | 起始n(A) | 起始n(B) | 其他条件 |
| I组 | 500℃ | 1 L | 1mol | 2mol | 无 |
| II组 | 500℃ | 1 L | 2mol | 4mol | 无 |
| III组 | 500℃ | 1 L | 1mol | 2mol |
已知I组实验过程中,C气体的体积分数c%随时间t的变化如下图所示,达到平衡后C 气体的体积分数为a%,其浓度为b mol/L。
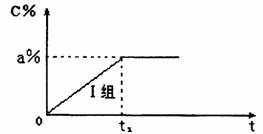
(1)请在上图中画出II组实验过程中,C气体的体积分数c%随时间t的变化的曲线。
(2)若III组实验过程中,C气体的体积分数随时间变化的曲线与II组相当,则它所具备的其他条件可能是 。
(3)在I组实验中B气体的转化率等于 。若将实验的温度变为800℃,则达平衡所需时间 (填“>”、“<”或“=”)t1,平衡时C气体的体积分数C% (填“>”、“<”或“=”)a%。
(4)保持温度500℃和1L体积不变,起始时只充入ymol的C,若达平衡后C气体的浓度依然为bmol/L,则y的值为 。若达平衡后C气体的体积分数依然为a%,则y的取值范围 。
查看习题详情和答案>>
(1)该合成路线对于环境保护的价值在于
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因:
(3)CH3OH(l)、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:
(4)据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇也已成为现实.
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)下列叙述正确的是
a.使用Cu-Zn-Fe催化剂可大大提高生产效率
b.反应需在300℃进行可推测该反应是吸热反应
c.充入大量CO2气体可提高H2的转化率
d.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率.
(10分)在一定条件下,物质A~E转化关系如下图所示,其中A为单质,常温下E为无色液体。
(1)若A、C、D均含氯元素,C为氯碱工业的原料,D的溶液具有漂白性。
①A与B反应的化学方程式是 。
②D的溶液可使KI淀粉溶液显蓝色,则D与KI在溶液中反应的离子方程式是 。
③检验C中所含阴离子的实验方法是 。
(2)若A为银白色金属,B为某酸的浓溶液。常温下该反应不能进行,加热后可以发生反应。C可用于做净水剂,D为可形成酸雨的无色气体。C与过量氢氧化钠溶液反应的离子方程式是 。
(3)上述(1)、(2)中的D都能使品红溶液褪色,利用褪色后的溶液探究使其褪色的物质的实验方法是 。
查看习题详情和答案>>
(10分)在一定条件下,物质A~E转化关系如下图所示,其中A为单质,常温下E为无色液体。 
(1)若A、C、D均含氯元素,C为氯碱工业的原料,D的溶液具有漂白性。
①A与B反应的化学方程式是 。
②D的溶液可使KI淀粉溶液显蓝色,则D与K I在溶液中反应的离子方程式是
I在溶液中反应的离子方程式是  。
。
③检验C中所含阴离子的实验方法是 。
(2)若A为银白色金属,B为某酸的浓溶液。常温下该反应不 能进行,加热后可以发生反应。C可用于做净水剂,D为可形成酸雨的无色气体。C与过量氢氧化钠溶液反应的离子方程式是
能进行,加热后可以发生反应。C可用于做净水剂,D为可形成酸雨的无色气体。C与过量氢氧化钠溶液反应的离子方程式是  。
。
(3)上述(1)、(2)中的D都能使品红溶液褪 色,利用褪色后的溶液探究使其褪色的物质的实验方法是 。
色,利用褪色后的溶液探究使其褪色的物质的实验方法是 。
(10分)
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g)△H<O
2SO3(g)△H<O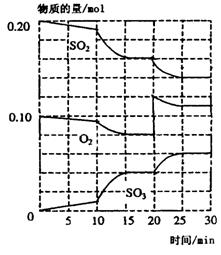
(1)600℃时,在-2L密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间段是__________;
(2)20—25min,O2的平均反应速率为__________;
(3)10min到15min的曲线变化的原因可能是__________ (填编号);
a.加 了催化剂 b.扩大容器体积
了催化剂 b.扩大容器体积
c.降低温度 d.增加SO3的物质的量
(4)据图判断。反应进行至20min时,曲线发生变化的原因是(用文字表达)__________。