摘要:A.B.C是短周期中的三种元素.原子序数依次递增.A与C为同族元素.C与A可形成原子个数比为1:2或1:3的化合物.B与A只能形成一种化合物.则下列说法正确的是 A.原子半径:A>B>C B.B与A形成的化合物熔点较高 C.B只能是金属 D.B可能是金属.也可能是非金属
网址:http://m.1010jiajiao.com/timu3_id_386676[举报]
A、B、C为短周期的三种元素,已知A、B处于同一周期;A、C的最低价离子分别为 和
和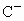 ,
,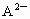 的离子半径大于
的离子半径大于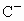 ;
;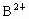 与
与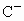 具有相同的电子层结构,以下叙述中不正确的是
具有相同的电子层结构,以下叙述中不正确的是
[ ]
A.原子半径A>B>C
B.原子序数A>B>C
C.离子半径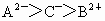
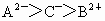
D.最外层电子数C>A>B
A、B、C为短周期的三种元素,已知A、B处于同一周期;A、C的最低价离子分别为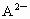 和
和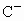 ,
,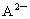 的离子半径大于
的离子半径大于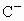 ;
;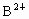 与
与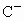 具有相同的电子层结构,以下叙述中不正确的是
具有相同的电子层结构,以下叙述中不正确的是
[ ]
A.原子半径A>B>C
B.原子序数A>B>C
C.离子半径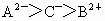
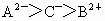
D.最外层电子数C>A>B
A、B、C是三种短周期元素,它们的原子序数依次增大.已知A是地壳中含量最多的元素;B元素原子的最外层只有一个电子;C元素的单质在常温下是黄绿色的气体.
①写出A、B的元素名称:A
②写出C元素最高价氧化物对应水化物的化学式
查看习题详情和答案>>
①写出A、B的元素名称:A
氧
氧
,B钠
钠
②写出C元素最高价氧化物对应水化物的化学式
HClO4
HClO4
.A、B、C、D、E、F六种元素,原子序数依次递增,其中A、B、C、D、E均为短周期元素.A元素原子核内无中子;B元素原子最外层电子数是次外层电子数的2倍;D是地壳中含量最高的元素;E和D同主族;F位于周期表的第四周期ⅠA族.根据以上信息用相关的元素符号回答下列问题:
(1)写出C、E的化学式:
(2)B与D形成化合物BD2的分子式为
(3)A2D的沸点比A2E高的原因是
(4)常温常压时,2.8g BD气体在3.2g D2气体中完全燃烧,生成BD2气体时放出28、3kJ的热量,则表示BD燃烧热的热化学方程式是
(5)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式
查看习题详情和答案>>
(1)写出C、E的化学式:
N
N
;S
S
.(2)B与D形成化合物BD2的分子式为
CO2
CO2
,空间构型为直线形
直线形
.(3)A2D的沸点比A2E高的原因是
直线型
直线型
.(4)常温常压时,2.8g BD气体在3.2g D2气体中完全燃烧,生成BD2气体时放出28、3kJ的热量,则表示BD燃烧热的热化学方程式是
CO(g)+
O2(g)=CO2(g)△H=-283KJ/mol
| 1 |
| 2 |
CO(g)+
O2(g)=CO2(g)△H=-283KJ/mol
.| 1 |
| 2 |
(5)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
.
| ||