网址:http://m.1010jiajiao.com/timu3_id_386650[举报]
(8分)Ⅰ.(1)饱和氯化铵溶液显酸性,原因是
________________________________________________________________________
________________________________________________________________________;
向饱和氯化铵溶液中加入少量Mg(OH)2固体,固体完全溶解;其合理的解释(用相关离子方程式表示)为
________________________________________________________________________
________________________________________________________________________。
(2)向Mg(OH)2悬浊液中加入适量CH3COONH4溶液,
Mg(OH)2能否完全溶解________(填“能”或“否”),理由是
________________________________________________________________________
________________________________________________________________________。
Ⅱ.硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4===H++HSO4-,HSO4-===H++SO42-。
请回答下列有关问题:
(1)Na2SO4溶液呈________(填“弱酸性”“中性”或“弱碱性”),其理由是________________________________________________________________________
(用离子方程式表示);
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为
________________________________________________________________________
________________________________________________________________________。
(3)在0.10 mol·L-1的Na2SO4溶液中,下列离子浓度关系正确的是________(填写编号);
A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4)
B.c(OH-)=c(HSO4-)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(4)写出NaHSO4溶液中溶质电离常数(Ka)的表达式________________;
(5)若25℃时,0.10 mol·L-1的NaHSO4溶液中c(SO2-4)=0.029 mol·L-1,则0.10 mol·L-1的H2SO4溶液中c(SO42-)________0.029mol·L-1(填“<”“>”或“=”),其理由是________________________________________________________________________;
(6)如果25℃时,0.10 mol·L-1H2SO4溶液的pH=
-lg 0.11,则0.10 mol·L-1的H2SO4溶液中c(SO42-)=________mol·L-1。
查看习题详情和答案>>
(8分)(1)表中为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
| 烯类化合物 | 相对速率 |
| (CH3)2C===CHCH3 | 10.4 |
| CH3CH===CH2 | 2.03 |
| CH2===CH2 | 1.00 |
| CH2===CHBr | 0.04 |
(2)下列化合物与氯化氢加成时,取代基对速率的影响规律类似,其中反应速率最慢的是________(填代号)。
A.(CH3)2C===C(CH3)2
B.CH3CH===CHCH3
C.CH2===CH2
D.CH2===CHCl
(3)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2===CHCH3+HBr―→

下列框图中B、C、D都是相关反应中的主要产物(部分条件、试剂被省略),且化合物B中仅有4个碳原子、1个溴原子、1种氢原子。
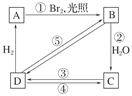
上述框图中,B的结构简式为________;属于取代反应的有________(填框图中序号),属于消去反应的有________(填序号);写出反应④的化学方程式(只写主要产物,标明反应条件):________________________________________________________________________。 查看习题详情和答案>>
(8分)(1)表中为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
|
烯类化合物 |
相对速率 |
|
(CH3)2C===CHCH3 |
10.4 |
|
CH3CH===CH2 |
2.03 |
|
CH2===CH2 |
1.00 |
|
CH2===CHBr |
0.04 |
据表中数据,总结烯类化合物加溴时,反应速率与C===C上取代基的种类、个数间的关系:________________________________________________________________________。
(2)下列化合物与氯化氢加成时,取代基对速率的影响规律类似,其中反应速率最慢的是________(填代号)。
A.(CH3)2C===C(CH3)2
B.CH3CH===CHCH3
C.CH2===CH2
D.CH2===CHCl
(3)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2===CHCH3+HBr―→

下列框图中B、C、D都是相关反应中的主要产物(部分条件、试剂被省略),且化合物B中仅有4个碳原子、1个溴原子、1种氢原子。
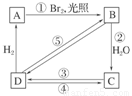
上述框图中,B的结构简式为________;属于取代反应的有________(填框图中序号),属于消去反应的有________(填序号);写出反应④的化学方程式(只写主要产物,标明反应条件):________________________________________________________________________。
查看习题详情和答案>>
(8分)(1)表中为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
| 烯类化合物 | 相对速率 |
| (CH3)2C===CHCH3 | 10.4 |
| CH3CH===CH2 | 2.03 |
| CH2===CH2 | 1.00 |
| CH2===CHBr | 0.04 |
据表中数据,总结烯类化合物加溴时,反应速率与C===C上取代基的种类、个数间的关系:________________________________________________________________________。
(2)下列化合物与氯化氢加成时,取代基对速率的影响规律类似,其中反应速率最慢的是________(填代号)。
A.(CH3)2C===C(CH3)2
B.CH3CH===CHCH3
C.CH2===CH2
D.CH2===CHCl
(3)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2===CHCH3+HBr―→
下列框图中B、C、D都是相关反应中的主要产物(部分条件、试剂被省略),且化合物B中仅有4个碳原子、1个溴原子、1种氢原子。
上述框图中,B的结构简式为________;属于取代反应的有________(填框图中序号),属于消去反应的有________(填序号);写出反应④的化学方程式(只写主要产物,标明反应条件):________________________________________________________________________。
查看习题详情和答案>>
(8分)Ⅰ.(1)饱和氯化铵溶液显酸性,原因是
________________________________________________________________________
________________________________________________________________________;
向饱和氯化铵溶液中加入少量Mg(OH)2固体,固体完全溶解;其合理的解释(用相关离子方程式表示)为
________________________________________________________________________
________________________________________________________________________。
(2)向Mg(OH)2悬浊液中加入适量CH3COONH4溶液,
Mg(OH)2能否完全溶解________(填“能”或“否”),理由是
________________________________________________________________________
________________________________________________________________________。
Ⅱ.硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4===H++HSO4-,HSO4-===H++SO42-。
请回答下列有关问题:
(1)Na2SO4溶液呈________(填“弱酸性”“中性”或“弱碱性”),其理由是________________________________________________________________________
(用离子方程式表示);
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为
________________________________________________________________________
________________________________________________________________________。
(3)在0.10 mol·L-1的Na2SO4溶液中,下列离子浓度关系正确的是________(填写编号);
| A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4) |
| B.c(OH-)=c(HSO4-)+c(H+) |
| C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) |
| D.c(Na+)=2c(SO42-)+2c(HSO4-) |
(5)若25℃时,0.10 mol·L-1的NaHSO4溶液中c(SO2-4)=0.029 mol·L-1,则0.10 mol·L-1的H2SO4溶液中c(SO42-)________0.029 mol·L-1(填“<”“>”或“=”),其理由是________________________________________________________________________;
(6)如果25℃时,0.10 mol·L-1H2SO4溶液的pH=
-lg 0.11,则0.10 mol·L-1的H2SO4溶液中c(SO42-)=________mol·L-1。 查看习题详情和答案>>