摘要:已知某温度下的热化学方程式:2SO2(气)+O2(气)2SO3,△H= -197KJ/mol.在同温同压下.向密闭容器中通入2molSO2和1molO2.达平衡时放出热量Q1KJ,向另一相同的密闭容器中通入1.5molSO2.0.75molO2和0.5molSO3.达平衡时放出热量Q2KJ.下列关系正确的是 ( ) A.Q1=Q2=197 B.Q1=Q2<197 C.Q1<Q2<197 D.Q2<Q1<197
网址:http://m.1010jiajiao.com/timu3_id_386625[举报]
|
已知某温度下的热化学方程式:2SO2(气)+O2(气) | |
| [ ] | |
A. |
Q1<Q2<197 |
B. |
Q1=Q2<197 |
C. |
Q1>Q2>197 |
D. |
Q2<Q1<197 |
已知某温度下的热化学方程式:2SO2(气)+O2(气)![]() 2SO3(气);
2SO3(气);
![]() △H= -197kJ/mol,在同温同压下向密闭容器中通入2 mol SO2和1 molO2,达平衡时放出热量Q1 kJ;向另一相同的密闭容器中通入1.5 mol SO2 、0.75 molO2 和0.5mol SO3达平衡时放出热量Q2 kJ,下列关系正确的是
△H= -197kJ/mol,在同温同压下向密闭容器中通入2 mol SO2和1 molO2,达平衡时放出热量Q1 kJ;向另一相同的密闭容器中通入1.5 mol SO2 、0.75 molO2 和0.5mol SO3达平衡时放出热量Q2 kJ,下列关系正确的是
A.Q1< Q2< 197 B.Ql= Q2< 197
![]() C.Q1> Q2> 197 D.Q2< Q1< 197
C.Q1> Q2> 197 D.Q2< Q1< 197
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3;2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题
(1)硫酸生产中,SO2催化氧化生成SO3;2SO2(g)+O2(g)
 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题 
①2SO2(g)+O2(g) 2SO3(g)的△H________0(填“>”或“”“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不移动”)
2SO3(g)的△H________0(填“>”或“”“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不移动”)
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1_______K2;反应进行到状态D时, _____
_____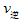 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
 2SO3(g)的△H________0(填“>”或“”“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不移动”)
2SO3(g)的△H________0(填“>”或“”“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不移动”) ②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1_______K2;反应进行到状态D时,
 _____
_____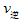 (填“>”“<”或“=”)
(填“>”“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
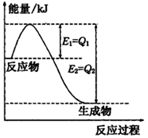
① 如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式:__________________(△H的数值用含字母Q1、Q2的代数式表示)
②氨气溶于水得到氨水,在25℃下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+)_______c(Cl-)(填“>”、“<”或“=“);用含a和b的代数式表示出该混合溶液中氨水的电离平衡常数____________。
(3)海水中含有大量的元素,常量元素如氯。已知AgCl + Cl- = [AgCl2]-,下图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
②氨气溶于水得到氨水,在25℃下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+)_______c(Cl-)(填“>”、“<”或“=“);用含a和b的代数式表示出该混合溶液中氨水的电离平衡常数____________。
(3)海水中含有大量的元素,常量元素如氯。已知AgCl + Cl- = [AgCl2]-,下图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:

①由图知该温度下AgCl的溶度积常数为_______________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:____________________________
③该温度下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于_____mol·L-1(此温度时Ksp(AgI)=1.2×10-16)
查看习题详情和答案>>
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:____________________________
③该温度下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于_____mol·L-1(此温度时Ksp(AgI)=1.2×10-16)
如图所示的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.

试回答下列问题:
(1)D的电子式为
 ;
;
(2)写出D+H+X→A的化学方程式:
(3)写出C→H的离子方程式:
(4)写出D与K反应生成的正盐的化学式:
(5)已知1mol H(g)完全转化为I(g)时放热98.3kJ,则此反应的热化学方程式为
(6)一定温度下,有可逆反应:aD(g)+bY(g)?cE(g)+dX(g).在2L密闭容器中,充入4mol D和5mol Y,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了
.则前2min内用E表示的平均反应速率为
查看习题详情和答案>>

试回答下列问题:
(1)D的电子式为


(2)写出D+H+X→A的化学方程式:
NH3+SO2+H2O═NH4HSO3
NH3+SO2+H2O═NH4HSO3
;(3)写出C→H的离子方程式:
SO32-+2H+═SO2↑+H2O
SO32-+2H+═SO2↑+H2O
;(4)写出D与K反应生成的正盐的化学式:
(NH4)2SO4
(NH4)2SO4
;(5)已知1mol H(g)完全转化为I(g)时放热98.3kJ,则此反应的热化学方程式为
2SO2(g)+O2(g)=2SO3(g)△H=-196.6 kJ?mol-1
2SO2(g)+O2(g)=2SO3(g)△H=-196.6 kJ?mol-1
;某条件下,当加入4mol H和2mol Y后,放出314.56kJ的热时,此时H的转化率为80%
80%
;(6)一定温度下,有可逆反应:aD(g)+bY(g)?cE(g)+dX(g).在2L密闭容器中,充入4mol D和5mol Y,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了
| 1 | 18 |
0.5
0.5
mol?L-1?min-1,平衡时D的浓度为1
1
mol?L-1.(2011?宝鸡三模)[化学一选修2化学与技术]分析下面两个案例并回答有关问题.
(1)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N282%):
①利用表中数据,如何推断出SO2的催化氧化反应是一个放热反应?
②选择适应的催化剂,是否可以提高SO2的转化率?
③已知:2SO2(g)+O2(g)
2SO3(g),△H=-196.6k J/mol,计算每生产1万吨98%硫酸所需要SO3质量为
(2)某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土,拟在该地区建设大型炼铁厂.
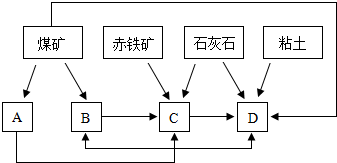
①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系.据此确定上图中相应工厂的名称B
②以赤铁矿为原料,写出高炉炼铁中得到生铁以及产生炉渣的化学方程式
③从“三废”利用、环境保护等角度考虑,该地区和企业在生产中应采取的一些措施有(举出1种措施即可)
查看习题详情和答案>>
(1)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N282%):
|
压强/MPa SO2转化率 温度/℃ |
0.1 |
0.5 |
1 |
10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
压强一定时,温度升高时,SO2的转化率降低,说明升高温度有利于平衡向逆反应移动,故正反应为放热反应
压强一定时,温度升高时,SO2的转化率降低,说明升高温度有利于平衡向逆反应移动,故正反应为放热反应
②选择适应的催化剂,是否可以提高SO2的转化率?
否
否
(填“是”或“否”)是否可以增大该反应所放出的热量?否
否
(填“是”或“否”).③已知:2SO2(g)+O2(g)
| ||
| △ |
8×103
8×103
t,由SO2生产这些SO3时放出的热量为9.85×109
9.85×109
kJ.(2)某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土,拟在该地区建设大型炼铁厂.

①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系.据此确定上图中相应工厂的名称B
焦化厂
焦化厂
、D水泥厂
水泥厂
.②以赤铁矿为原料,写出高炉炼铁中得到生铁以及产生炉渣的化学方程式
Fe2O3+3CO
2Fe+3CO2 、CaCO3+SiO2
CaSiO3+CO2
| ||
| ||
Fe2O3+3CO
2Fe+3CO2 、CaCO3+SiO2
CaSiO3+CO2
.
| ||
| ||
③从“三废”利用、环境保护等角度考虑,该地区和企业在生产中应采取的一些措施有(举出1种措施即可)
用炼铁厂的炉渣(或CaSiO3)作为水泥厂的原料;或用发电厂的煤矸石和粉煤灰作为水泥厂的原料;或将石灰石煅烧成生石灰,用于吸收发电厂和焦化厂燃煤时产生的SO2,减少对空气的污染;或建立污水处理系统
用炼铁厂的炉渣(或CaSiO3)作为水泥厂的原料;或用发电厂的煤矸石和粉煤灰作为水泥厂的原料;或将石灰石煅烧成生石灰,用于吸收发电厂和焦化厂燃煤时产生的SO2,减少对空气的污染;或建立污水处理系统
.