网址:http://m.1010jiajiao.com/timu3_id_386530[举报]
常温下有0. 1 mol/L的以下几种溶液,①H2SO4溶液②NaHSO4溶液③CH3COOH溶液④HCl溶液⑤HCN溶液⑥NH3·H2O,其中如下几种溶液的电离度(即已经电离的占原来总的百分数)如下表(已知H2SO4的第一步电离是完全的),回答下面问题:
|
①H2SO4溶液HSO4- |
②NaHSO4溶液HSO4- |
③CH3COOH |
④HCl溶液 |
|
10% |
29% |
1.33% |
100% |
(1)常温下,pH相同的表格中几种溶液,其物质的量浓度由大到小的顺序是(填序号,下同) _
(2)常温下,将足量的锌粉投人等体积pH=1的表格中几种溶液中,产生H2的体积(同温
同压下)由大到小的顺序是_ _
(3)在25℃时,若用已知浓度的NaOH滴定未知浓度的CH3 COOH应选用_ 作指示剂,若终点时溶液pH = a,则由水电离的。c(H+)为_ 。
(4)在25℃时,将b mol·L-1的KCN溶液与0. O1 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH = 7,则KCN溶液的物质的量浓度b_ 0.01 mol·L-1填“>”、“<”或“=”);用含b的代数式表示HCN的电离常数Ka=
查看习题详情和答案>>
(14分)某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
在园底烧瓶中加人12.2g 苯甲酸和20 mL 甲醇(密度约0.79g · mL-1) ,再小心加人3 mL 浓硫酸,混匀后,投人几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)浓硫酸的作用是_________;若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:__________________。
(2)甲和乙两位同学分别设计了如下图两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用__________装置(填“甲”或“乙”)。理由是___________________。

(3)反应物CH3 OH 应过量,理由是__________________________________。
II.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图中方括号内填人恰当操作方法的名称。

(5)以上流程图中加人Na2CO3溶液后,放人分液漏斗中振荡、静置,要得到有机层,其具体操作是______________________________________________________________________
(6)通过计算,苯甲
 酸甲酯的产率为_________________________。
查看习题详情和答案>>
酸甲酯的产率为_________________________。
查看习题详情和答案>>
在温度、容积相同的3个密闭容器中,按不同方式投人反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下表
[已知

下列说法错误的是
A.2c1 <c3 B. a+6 =92. 4
C. 2p2 <p3 D. a1 +a3 <1
查看习题详情和答案>>
氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s)  Fe3O4(s)+4H2(g)
△H=akJ/mol (I)
Fe3O4(s)+4H2(g)
△H=akJ/mol (I)
2Fe3O4(s)  6FeO(s)+O2(g) △H=bkJ/mol (II)
6FeO(s)+O2(g) △H=bkJ/mol (II)
下列坐标图分别表示FeO的转化率(图-1 )和一定温度时,H2出生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图-2)。
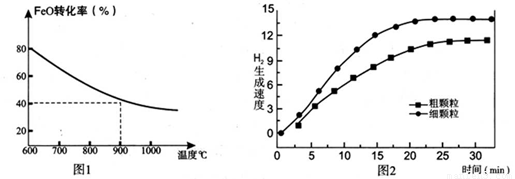
(1)反应:2H2O(g)=2H2(g)+O2(g) △H= (用含a、b代数式表示);
(2)上述反应b>0,要使该制氢方案有实际意义,从能源利用及成本的角度考虑,实现反 应II可采用的方案是: ;
(3)900°C时,在两个体积均为2.0L密闭容器中分别投人0.60molFeO和0.20mol H2O(g)甲容器用细颗粒FeO、乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②细颗粒FeO时H2O(g)的转化率比用粗颗粒FeO时 H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计箅过程,保留两位有效数字)。
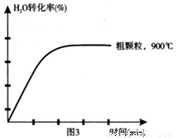
(4)在下列坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注)。
查看习题详情和答案>>