摘要:(北京市崇文区2008统一练习)(1)下列曲线分别表示元素的某种性质与该电荷数的关系(Z为该电荷数.Y为元素的有关性质).请把与下面元素有关性质相符的曲线标号填入相应的空格中: ①ⅡA族元素的在外层电子数 . ②第3周期元素的最高化合价 . ③F-. Na+ .Mg2+.Al3+的离子半径 . (2)元素X.Y.Z.M.N均为短周期主族元素.且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3∶4,M原子的最外层电子数与次外电子数之比为3∶4,N-.Z+.X+离子半径逐渐减小,化合物XN常温下为气体. 据此回答: ①N的最高价氧化物的水化物的化学式是 . ②化合物A.B均为由上述五种元素中的任意三种元素组成的强电解质.且两种物质水溶液的酸碱性相同.组成元素的原子数目之比均为1∶1∶1.A溶液中水的电离程度最小.则化合物A中的化学键类型为 .若B为常见家用消毒剂的主要成分.则B的化学式是 . ③Z与M形成的稳定固体化合物的电子式为 . ④X与Y.X与M均可形成18电子分子.写出这两种分子在水溶液中反应生成一种可观察到的实验现象是 .
网址:http://m.1010jiajiao.com/timu3_id_386292[举报]
 (2012?湖南一模)低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.
(2012?湖南一模)低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.已知:CO(g)+H2O(g)?H2(g)+CO2(g)△H=a kJ?mol-1 的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
放热
放热
反应(填“放热”或“吸热”).t1℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3[m] |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①与2min时相比,3min时密闭容器中混合气体的平均摩尔质量
不变
不变
(填增大、减小或不变).②表中3min~4min之间反应处于
化学平衡
化学平衡
状态;CO的体积分数大于
大于
16% (填大于、小于或等于).③反应在4min~5min,平衡向逆方向移动,可能的原因是
D
D
(单选),表中5min~6min之间数值发生变化,可能的原因是A
A
(单选).A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(3)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为
75%
75%
.下表是稀硫酸与某金属反应的实验数据.分析数据,回答下列问题:
(1)实验4和5表明,
(2)仅表明反应物浓度对反应速率产生影响的实验有
(3)本实验中影响反应速率的其他因素还有
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
查看习题详情和答案>>
| 实验序号 | 金属 质量/g |
C(H2SO4) /mol?L-1 |
C(H2SO4) /mol?L-1 |
V(H2SO4) /mL |
溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
固体反应物的表面积
固体反应物的表面积
对反应速率有影响,表面积越大
表面积越大
,则反应速率越快,表中能表明同一规律的实验还有1和2
1和2
(填实验序号);(2)仅表明反应物浓度对反应速率产生影响的实验有
1、3、4、6或2、5
1、3、4、6或2、5
(填实验序号);(3)本实验中影响反应速率的其他因素还有
开始反应温度
开始反应温度
,其实验序号是6和7
6和7
.(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
一定量的金属跟足量的硫酸反应放出的热量相同
一定量的金属跟足量的硫酸反应放出的热量相同
.碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用.
(1)人体中碘的重要来源之一是加碘食盐.加碘食盐中的碘元素以碘酸钾(KIO3)的形式存在,其碘元素的化合价是
(2)海带或海苔中含有丰富的碘元素,也是人体碘的一种来源.取海带灰的浸取液加硫酸酸化,再加入少量H2O2溶液与淀粉溶液,溶液变蓝,证明海带中含有碘元素.反应的离子方程式是
(3)2012年3月,北京市最新规定食盐中碘含量标准为(18~33)mg/kg.为测定加碘食盐样品的碘含量,某实验小组设计了如下步骤:
Ⅰ.用天平准确称取10.0g食盐样品,加适量蒸馏水使其完全溶解.
Ⅱ.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全.
Ⅲ.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol?L-1的Na2S2O3溶液6.0mL,恰好反应完全.(已知:I2+2S2
=2I-+S4
)
①步骤Ⅱ中反应的离子方程式是
②步骤Ⅲ中判断反应恰好完全的现象是
③上述实验样品中碘含量是
查看习题详情和答案>>
(1)人体中碘的重要来源之一是加碘食盐.加碘食盐中的碘元素以碘酸钾(KIO3)的形式存在,其碘元素的化合价是
+5
+5
.加碘食盐的食用方法是“待食品熟后加入”,说明碘酸钾在受热时易分解
分解
.(2)海带或海苔中含有丰富的碘元素,也是人体碘的一种来源.取海带灰的浸取液加硫酸酸化,再加入少量H2O2溶液与淀粉溶液,溶液变蓝,证明海带中含有碘元素.反应的离子方程式是
H2O2+2I-+2H+=I2+2H2O
H2O2+2I-+2H+=I2+2H2O
.(3)2012年3月,北京市最新规定食盐中碘含量标准为(18~33)mg/kg.为测定加碘食盐样品的碘含量,某实验小组设计了如下步骤:
Ⅰ.用天平准确称取10.0g食盐样品,加适量蒸馏水使其完全溶解.
Ⅱ.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全.
Ⅲ.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol?L-1的Na2S2O3溶液6.0mL,恰好反应完全.(已知:I2+2S2
| O | 2- 3 |
| O | 2- 6 |
①步骤Ⅱ中反应的离子方程式是
IO3-+5I-+6H+=3I2+3H2O
IO3-+5I-+6H+=3I2+3H2O
.②步骤Ⅲ中判断反应恰好完全的现象是
蓝色褪去
蓝色褪去
.③上述实验样品中碘含量是
25.4
25.4
mg/kg,符合北京市规定.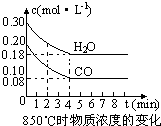 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大
可逆反应进行的程度越大
;K值大小与温度的关系是:温度升高,K值可能增大也可能减小
可能增大也可能减小
(填“一定增大”、“一定减小”、或“可能增大也可能减小”).(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0 CO和H2O浓度变化如右图,则 0-4min的平均反应速率v(CO)=
0.03mol/(L?min)
0.03mol/(L?min)
,该温度下平衡常数K的数值为1
1
.(3)t1℃(t1>850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表.
①表中3min-4min之间反应处于
平衡
平衡
状态; c1数值大于
大于
0.08mol/L (填大于、小于或等于).②反应在4min-5min间,平衡向逆方向移动,可能的原因是
d
d
(单选),表中5min-6min之间数值发生变化,可能的原因是a
a
(单选).a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
(2011?崇文区模拟)U、W、X、Y、Z都是短周期元素,且原子序数依次增大.其中U与W可形成三角锥形分子A,U与X可形成常温下呈液态的分子B,A、B均为10电子分子;Y元素原子的K层电子数与M层电子数相同;Z元素的单质、氧化物均为原子晶体.
请回答下列问题:
(1)Z元素在周期表中的位置
(2)U与X形成的18电子化合物的电子式是
 .
.
(3)ZX2与NaOH溶液反应的化学方程式是
(4)你认为U、W、X元素形成的化合物之间
(5)一定量的Y单质在足量二氧化碳中充分燃烧的化学方程式是
或
或
g(用含a的代数式表示).
查看习题详情和答案>>
请回答下列问题:
(1)Z元素在周期表中的位置
第三周期ⅣA族
第三周期ⅣA族
.W、X、Y、Z四种元素的原子半径由小到大的顺序是O<N<Si<Mg
O<N<Si<Mg
(用元素符号表示).(2)U与X形成的18电子化合物的电子式是


(3)ZX2与NaOH溶液反应的化学方程式是
SiO2+2NaOH=Na2SiO3+H2O
SiO2+2NaOH=Na2SiO3+H2O
.(4)你认为U、W、X元素形成的化合物之间
不能
不能
(填“能”或“不能”)发生如下反应:WX+WU3→UWX2+U2X,得出此结论的理由是在此反应关系中,只有失电子的物质,没有得电子的物质
在此反应关系中,只有失电子的物质,没有得电子的物质
.(5)一定量的Y单质在足量二氧化碳中充分燃烧的化学方程式是
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
,将生成的全部固体与足量的热浓硝酸混合,充分反应后,产物中二氧化碳和二氧化氮共a L(标准状况),则Y单质的质量是
| ||
| 2×24a |
| 22.4×5 |
| 3a |
| 7 |
| 2×24a |
| 22.4×5 |
| 3a |
| 7 |