摘要:32.下表是元素周期表的一部分.表中字母分别代表某一化学元素.请回答有关问题. (1) 人们曾认为g.h.i不发生化学反应.因而把它们叫做稀有气体.但是后来发现这族气体可以参加化学反应.你认为g.h.i中最有可能首先被发现可以参加化学反应的元素是 . (2)e是周期表中的 族元素.最外层电子数为 . (3)a的阴离子半径 b的阳离子半径. (4)在元素周期表中有一个对角线规则.其中包括b.c的化合物的性质十分相似.则b的氯化物与少量和过量的氢氧化钠溶液发生反应的化学方程式分别为(要表达出具体的元素符号.下同) , . (5)f的+4价氧化物可与浓盐酸反应.且已知其氧化性强于氯气.则该氧化物与浓盐酸反应的化学方程式可表示为 . (6)元素周期表第6周期中的镧系元素共有 种.它们原子的电子层结构和性质十分相似. (7)根据NaH的存在.有人提议可将氢元素放在VIIA族.那么根据其最高正价与最低负价的绝对值相等.又可以把氢元素放在周期表中的 族.
网址:http://m.1010jiajiao.com/timu3_id_385968[举报]
下表是元素周期表的一部分,表中所列字母分别代表短周期中的一种元素.
(1)A单质的电子式是
 ;B元素在周期表中的位置是
;B元素在周期表中的位置是
(2)D单质与C的最高价氧化物对应水化物反应的离子方程式是
(3)B、C两元素分别形成的离子的半径关系:B
(4)A的气态氢化物与D的气态氢化物反应的产物是
(5)下列事实不能说明D的非金属性比A的非金属性强的是
a.D的氢化物比A的氢化物稳定
b.D的最高正化合价大于A的最高正化合价
c.D的最高价含氧酸比A的最高价含氧酸的酸性强.
查看习题详情和答案>>

(1)A单质的电子式是


第二周期第ⅥA族
第二周期第ⅥA族
.(2)D单质与C的最高价氧化物对应水化物反应的离子方程式是
Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
.(3)B、C两元素分别形成的离子的半径关系:B
<
<
C(填“>”“=”或“<”).(4)A的气态氢化物与D的气态氢化物反应的产物是
NH4Cl
NH4Cl
,该产物中含有的化学键类型是离子键、共价键
离子键、共价键
.(5)下列事实不能说明D的非金属性比A的非金属性强的是
ac
ac
.a.D的氢化物比A的氢化物稳定
b.D的最高正化合价大于A的最高正化合价
c.D的最高价含氧酸比A的最高价含氧酸的酸性强.
下表是元素周期表的一部分,表中的序号分别代表某一种化学元素.请按要求完成下列问题:
(1)写出元素⑦的元素名称
(2)元素?在元素周期表中的位置是
(3)用元素符号将①、②、③、⑥四种元素按原子半径由大到小的顺序排列
(4)在这些元素中,最活泼的金属元素是
(5)写出③、⑤两种元素的最高价氧化物对应的水化物反应的离子方程式
(6)写出①元素形成的4核10电子微粒的化学式
查看习题详情和答案>>

(1)写出元素⑦的元素名称
硫
硫
.(2)元素?在元素周期表中的位置是
四
四
周期,ⅤⅢ
ⅤⅢ
族.(3)用元素符号将①、②、③、⑥四种元素按原子半径由大到小的顺序排列
Na>Si>N>F
Na>Si>N>F
.(4)在这些元素中,最活泼的金属元素是
K
K
(填元素符号,下同),最活泼的非金属元素是F
F
,最不活泼的元素是Ar
Ar
.(5)写出③、⑤两种元素的最高价氧化物对应的水化物反应的离子方程式
OH-+Al(OH)3=[Al(OH)4]-
OH-+Al(OH)3=[Al(OH)4]-
.(6)写出①元素形成的4核10电子微粒的化学式
NH3
NH3
.下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素

(1)下列
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响.
原子核失去核外不同电子所需的能量(KJ?mol-1)
①通过上述信息和表中的数据分析,为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量
②表中X可能为13种元素中的
③Y是周期表中
④以上13种元素中,
(3)g元素原子基态时的核外电子排布式为
查看习题详情和答案>>

(1)下列
①④
①④
(填写编号)组元素的单质可能都是电的良导体.①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响.
原子核失去核外不同电子所需的能量(KJ?mol-1)
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
Li原子失去1个电子后形成稳定结构,再失去1个电子很困难
Li原子失去1个电子后形成稳定结构,再失去1个电子很困难
.②表中X可能为13种元素中的
a
a
(填写字母)元素.用元素符号表示X和j形成的化合物的化学式Na2O或Na2O2
Na2O或Na2O2
.③Y是周期表中
ⅢA
ⅢA
族的元素.④以上13种元素中,
m
m
(填写字母)元素原子失去核外第一个电子需要的能量最多.(3)g元素原子基态时的核外电子排布式为
1s22s22p63s23p63d104s24p2
1s22s22p63s23p63d104s24p2
.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)请写出字母O代表的元素符号
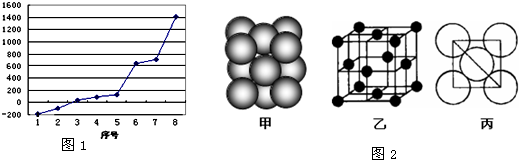
(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
(4)k与l形成的化合物kl2的电子式是
 ,它在常温下呈液态,形成晶体时,属于
,它在常温下呈液态,形成晶体时,属于
(5)i单质晶体中原子的堆积方式如图2(甲)所示,其晶胞特征如图2(乙)所示,原子之间相互位置关系的平面图如图2(丙)所示.若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
一个晶胞中i原子的数目为
(用M、NA、d表示).
(6)a与d构成的阳离子和i的阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓氢氧化钡溶液,产生的现象有:①溶液中出现白色沉淀并伴有有刺激性气味气体放出,②沉淀逐渐增多后又逐渐减少直至最终沉淀的量不变.写出沉淀的量不变时发生反应的离子方程式
查看习题详情和答案>>
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||

试回答下列问题:
(1)请写出字母O代表的元素符号
Fe
Fe
,该元素在周期表中的位置第四周期第 VIII族
第四周期第 VIII族
.(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
Si
Si
(填元素符号);其中电负性最大的是2
2
(填如图1中的序号).(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
SiC
SiC
(填化学式),试从结构角度加以解释:因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
.(4)k与l形成的化合物kl2的电子式是


分子
分子
晶体.(5)i单质晶体中原子的堆积方式如图2(甲)所示,其晶胞特征如图2(乙)所示,原子之间相互位置关系的平面图如图2(丙)所示.若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
一个晶胞中i原子的数目为
4
4
,该晶体的密度_
| ||
| 8NAd3 |
| ||
| 8NAd3 |
(6)a与d构成的阳离子和i的阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓氢氧化钡溶液,产生的现象有:①溶液中出现白色沉淀并伴有有刺激性气味气体放出,②沉淀逐渐增多后又逐渐减少直至最终沉淀的量不变.写出沉淀的量不变时发生反应的离子方程式
NH4++Al3++5OH-+2SO42-+2Ba2+=NH3↑+3H2O+AlO2-+2BaSO4↓
NH4++Al3++5OH-+2SO42-+2Ba2+=NH3↑+3H2O+AlO2-+2BaSO4↓
.