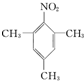
摘要:19 某同学设计了如下方案.来测定过氧化钠样品的纯度(杂质不参加反应.条件为标准状况). 实验原理:2Na2O2 + 2H2O = 4NaOH + O2↑ 通过测定生成的氧气的体积.经计算可确定样品中过氧化钠的含量. 实验步骤: ①称取过氧化钠样品2.00 g , ②把这些过氧化钠样品放入气密性良好的气体发生装置中, ③向过氧化钠样品中滴入水.用量筒排水集气.量筒内液面准确读数为110.0 mL, ④ 作为反应器的烧瓶中有54.0 mL液体, ⑤ 将烧瓶内的液体转移到250 mL的容量瓶内.并加水定容. 请回答下列问题: (1)有1000 mL. 500 mL .250 mL的量筒备用.则应选用 mL的量筒. (2)生成气体体积是 mL, 为保证生成气体体积的准确性.读取量筒刻度时应注意的问题是 . (3)据研究.与上述反应同时发生的反应还有:Na2O2 + 2H2O = 2NaOH + H2O2.H2O2的生成会使测定结果 . (4)为校正实验结果.该学生补做了如下实验:用移液管移取20.00 mL容量瓶中的液体.放入锥形瓶中.用0.0100 mol/L的KMnO4溶液去测定.至溶液中刚好出现浅浅的紫红色.停止滴定.用去了24.00 mLKMnO4溶液.配平化学反应式方程式: KMnO4 + H2O2 + H2SO4 -- K2SO4 + MnSO4 + O2↑ + H2O 该实验应选用 式滴定管. (5)通过以上数据计算.该过氧化钠的纯度为 . (6)如何避免因为生成H2O2造成的误差? .
网址:http://m.1010jiajiao.com/timu3_id_385162[举报]
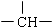 和苯环,其结构简式为
和苯环,其结构简式为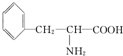
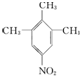 或
或