摘要:19..0.1mol/L NH3·H2O用水稀释后下列说法不正确的是 ①电离程度增大 ②OH-离子数目增多 ③pH值增大 ④导电性增强 A 只有① B 只有② C ③和④ D ①和②
网址:http://m.1010jiajiao.com/timu3_id_385140[举报]
为了证明一水合氨(NH3?H2O)是弱电解质,甲、乙、丙三人分别选用下列物质进行实验:0.010mol/L氨水、0.1mol/L NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水.
(1)甲用pH试纸测出0.010mol/L氨水的pH为l0,则认定一水合氨是弱电解质,你认为这一方法是否正确?
(2)乙取出10mL 0.010mol/L氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000mL,再用pH试纸测其pH=b.若要确认NH3?H2O是弱电解质,则a、b应满足什么关系?
(3)丙取出10mL 0.010mol/L氨水,滴入2滴酚酞试液,显粉红色,再加入少量NH4Cl晶体,溶液颜色变
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3?H2O是弱电解质:
查看习题详情和答案>>
(1)甲用pH试纸测出0.010mol/L氨水的pH为l0,则认定一水合氨是弱电解质,你认为这一方法是否正确?
正确
正确
(填“正确”或“不正确”),并说明理由:如果氨水是强碱,0.010mol?L-1氨水C(H+)=10-12mol/L,pH为12,实际上溶液的pH=10<12,所以氨水是弱碱
如果氨水是强碱,0.010mol?L-1氨水C(H+)=10-12mol/L,pH为12,实际上溶液的pH=10<12,所以氨水是弱碱
.(2)乙取出10mL 0.010mol/L氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000mL,再用pH试纸测其pH=b.若要确认NH3?H2O是弱电解质,则a、b应满足什么关系?
a>b>a-2
a>b>a-2
.(3)丙取出10mL 0.010mol/L氨水,滴入2滴酚酞试液,显粉红色,再加入少量NH4Cl晶体,溶液颜色变
浅
浅
(填“深”或“浅”).你认为这一方法能否证明NH3?H2O是弱电解质?能
能
(填“能”或“否”),并说明原因:向氨水中加入氯化铵后,如果氨水是弱电解质,则抑制氨水的电离,溶液中氢氧根离子浓度降低,溶液的碱性减弱,则溶液的颜色变浅,则说明氨水存在电离平衡;
向氨水中加入氯化铵后,如果氨水是弱电解质,则抑制氨水的电离,溶液中氢氧根离子浓度降低,溶液的碱性减弱,则溶液的颜色变浅,则说明氨水存在电离平衡;
.(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3?H2O是弱电解质:
选择0.1mol/L NH4Cl溶液和pH试纸,PH测定氯化铵溶液呈酸性,是因为铵根离子水解显酸性,说明一水合氨是弱电解质;
选择0.1mol/L NH4Cl溶液和pH试纸,PH测定氯化铵溶液呈酸性,是因为铵根离子水解显酸性,说明一水合氨是弱电解质;
.A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol?L-1C与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是______,E是______;
(2)用水稀释0.1mol?L-1B时,溶液中随着水量的增加而减小的是______ (填写序号)
a. 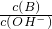 b.
b. c.c(H+)?c(OH-) d.n(OH-)
c.c(H+)?c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是______(填写序号)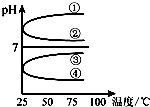
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的锌粉物质的量A=E
d.E溶液里有锌粉剩余
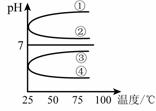
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中______曲线(填写序号).
(5)室温下,向0.01mol?L-1C溶液中滴加0.01mol?L-1D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为______.
查看习题详情和答案>>
A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol?L-1C与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是______,E是______;
(2)用水稀释0.1mol?L-1B时,溶液中随着水量的增加而减小的是______ (填写序号)
a. b.
b. c.c(H+)?c(OH-) d.n(OH-)
c.c(H+)?c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是______(填写序号)
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的锌粉物质的量A=E
d.E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中______曲线(填写序号).
(5)室温下,向0.01mol?L-1C溶液中滴加0.01mol?L-1D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为______.
查看习题详情和答案>>
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol?L-1C与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是______,E是______;
(2)用水稀释0.1mol?L-1B时,溶液中随着水量的增加而减小的是______ (填写序号)
a.
 b.
b. c.c(H+)?c(OH-) d.n(OH-)
c.c(H+)?c(OH-) d.n(OH-)(3)pH相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是______(填写序号)

a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的锌粉物质的量A=E
d.E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中______曲线(填写序号).
(5)室温下,向0.01mol?L-1C溶液中滴加0.01mol?L-1D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为______.
查看习题详情和答案>>
A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是 ,E是 ;
(2)用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是 (填写序号)
a.![]() b.
b.![]() c.c(H+)·c(OH-) d.n(OH-)
c.c(H+)·c(OH-) d.n(OH-)
 (3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E
d.E溶液里有镁粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高
温度(溶质不会分解)溶液pH随温度变化如右图中
_________曲线(填写序号) 。
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为___________________。
查看习题详情和答案>>A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol?L-1C与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是
(2)用水稀释0.1mol?L-1B时,溶液中随着水量的增加而减小的是
a.
b.
c.c(H+)?c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的锌粉物质的量A=E
d.E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中
(5)室温下,向0.01mol?L-1C溶液中滴加0.01mol?L-1D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为
查看习题详情和答案>>
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol?L-1C与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是
NaOH
NaOH
,E是CH3COOH
CH3COOH
;(2)用水稀释0.1mol?L-1B时,溶液中随着水量的增加而减小的是
a
a
(填写序号)a.
| c(B) |
| c(OH-) |
| c(H+) |
| c(OH-) |
(3)pH相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是
c
c
(填写序号)
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的锌粉物质的量A=E
d.E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中
④
④
曲线(填写序号).(5)室温下,向0.01mol?L-1C溶液中滴加0.01mol?L-1D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
.