摘要:50ml 0.50mol/L盐酸与50ml/0.55mol/LNaOH溶液在右图所示装置中进行中和反应.通过反应过程中所放出热量可计算中和热.回答下列问题 (1)装置图所示装置的不足之处为 . .若用此装置测得的中和热数值 (2)实验中改用60ml 0.50mol/L盐酸与50ml 0.55mol/L NaOH溶液进行反应.与上述实验相比.所放出的热量 .所测得中和热 .简述理由 (3)若含20.0gNaOH的稀溶液与足量稀盐酸反应放出28.7kJ热量.表示中和热的热化学方程式为
网址:http://m.1010jiajiao.com/timu3_id_384913[举报]
(1)0.5L 0.5mol/L FeCl3溶液中的Cl-的物质的量浓度为
(2)在
(3)中和相同体积、相同物质的量浓度的NaOH溶液,并使其生成正盐,需要相同物质的量浓度的盐酸、硫酸、磷酸溶液的体积比为
(4 )今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、H+、Mg2+、Ba2+、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加入足量NaHCO3溶液后,收集到气体0.03mol.
②第二份加足量Ba(NO3)2溶液充分反应后过滤干燥,得干燥沉淀4.66g.
根据上述实验回答:
(a)原溶液中一定不存在的离子是
(b)原溶液中可能存在的离子是
(c)请计算出原溶液中一定存在的阴离子的物质的量浓度
查看习题详情和答案>>
1.5mol/L
1.5mol/L
.(2)在
125
125
mL 0.2mol/L NaOH溶液中含1g溶质;配制50mL 0.2mol/L CuSO4溶液,需要CuSO4?5H2O2.5
2.5
g.(3)中和相同体积、相同物质的量浓度的NaOH溶液,并使其生成正盐,需要相同物质的量浓度的盐酸、硫酸、磷酸溶液的体积比为
6:3:2
6:3:2
.(4 )今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、H+、Mg2+、Ba2+、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加入足量NaHCO3溶液后,收集到气体0.03mol.
②第二份加足量Ba(NO3)2溶液充分反应后过滤干燥,得干燥沉淀4.66g.
根据上述实验回答:
(a)原溶液中一定不存在的离子是
Ba2+、CO32-
Ba2+、CO32-
.(b)原溶液中可能存在的离子是
K+、Mg2+
K+、Mg2+
.(c)请计算出原溶液中一定存在的阴离子的物质的量浓度
0.2mol/L
0.2mol/L
.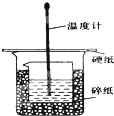 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出来的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出来的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中缺少的一种玻璃用品是
环形玻璃搅拌棒
环形玻璃搅拌棒
.(2)烧杯间填满碎纸条的作用是
防止热量损失
防止热量损失
.(3)大烧杯上如不盖硬纸板,求得的中和热数值
偏小
偏小
(填“偏大”、“偏小”或“无 影响”)(4)实验中改用60mL0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量
不相等
不相等
,(填“相等”或“不相等”).(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会
偏小
偏小
;用50mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值会无影响
无影响
.(均填“偏大”、“偏小”或“无影响”)将l00mL 0.1mol/L的BaCl2溶液与50mL 0.2mol/L的NaCl溶液混合(不考虑体积变化),则混合溶液中氯离子的物质的量浓度是( )
| A、0.2mol/L | B、0.01mol/L | C、0.lmol/L | D、0.02mol/L |
下列溶液中的Cl-浓度与100mL 0.5mol?L-1 AlCl3溶液中Cl-的浓度相等的是( )
| A、50mL 1.5mol?L-1的KCl溶液 | B、50mL 0.5mol?L-1的FeCl2溶液 | C、100mL 1mol?L-1的MgCl2溶液 | D、450mL 0.5mol?L-1的NaCl溶液 |