摘要:2 4OH-4e-=2H2O+O2↑ 2CuSO4+2H2O电解2Cu+O2↑+2H2SO4 (3)
网址:http://m.1010jiajiao.com/timu3_id_384864[举报]
(2010?朝阳区一模)铜及其化合物在生产、生活中有广泛的应用.
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2
2Cu+SO2
湿法炼铜:CuSO4+Fe═FeSO4+Cu
上述两种方法中,铜元素均被
(2)印刷电路板上使用的铜需要回收利用.
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2?2H2O,实验室模拟回收过程如下:
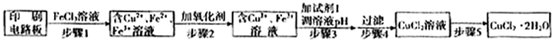
①证明步骤Ⅰ所加FeCl3溶液过量的方法是
②步骤2中所加的氧化剂最适宜的是
A.HNO3B.H2O2C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是
④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)═CuSO4(aq)+2H2O(l)△H1=-320kJ/mol
又知:2H2O(l)═2H2O(l)+O2(g)△H2=-196kJ/mol
H2(g)+
O2(g)═H2O(l)△H3=-286kJ/mol
则反应Cu(s)+H2SO4(aq)═CuSO4(aq)+H2(g)的△H=
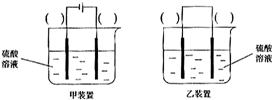
(3)欲实现反应Cu+H2SO2═CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)
查看习题详情和答案>>
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2
| ||
湿法炼铜:CuSO4+Fe═FeSO4+Cu
上述两种方法中,铜元素均被
还原
还原
(填“氧化”或“还原”)成铜单质.(2)印刷电路板上使用的铜需要回收利用.
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2?2H2O,实验室模拟回收过程如下:
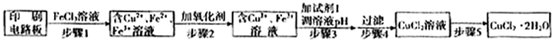
①证明步骤Ⅰ所加FeCl3溶液过量的方法是
取少量充分反应后的溶液于试管中,滴加KSCN溶液,若溶液变为红色,证明所加FeCl3溶液过量
取少量充分反应后的溶液于试管中,滴加KSCN溶液,若溶液变为红色,证明所加FeCl3溶液过量
.②步骤2中所加的氧化剂最适宜的是
B
B
.A.HNO3B.H2O2C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是
CuO或Cu(OH)2
CuO或Cu(OH)2
.(写出一种即可)④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是
CuCl2在溶液中可以发生水解反应,CuCl2+2H2O?Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解
CuCl2在溶液中可以发生水解反应,CuCl2+2H2O?Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解
(用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2?2H2O.方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)═CuSO4(aq)+2H2O(l)△H1=-320kJ/mol
又知:2H2O(l)═2H2O(l)+O2(g)△H2=-196kJ/mol
H2(g)+
| 1 |
| 2 |
则反应Cu(s)+H2SO4(aq)═CuSO4(aq)+H2(g)的△H=
+64kJ/mol
+64kJ/mol
.(3)欲实现反应Cu+H2SO2═CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)

电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下列装置是用燃烧法确定有机物分子式常用的装置(E中电炉省去).

(1)产生的氧气按从左到右的流向,所选装置各导管的连接顺序是
(2)C装置中浓H2SO4的作用是
(3)D装置中MnO2的作用是
(4)E燃烧管中CuO的作用是
(5)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则该有机物的最简式为
(6)要确立该有机物的分子式,还要知道
查看习题详情和答案>>

(1)产生的氧气按从左到右的流向,所选装置各导管的连接顺序是
g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a)
g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a)
.(2)C装置中浓H2SO4的作用是
吸收水分、干燥氧气
吸收水分、干燥氧气
.(3)D装置中MnO2的作用是
作催化剂、加快产生O2的速率
作催化剂、加快产生O2的速率
.(4)E燃烧管中CuO的作用是
使有机物充分氧化生成CO2和H2O
使有机物充分氧化生成CO2和H2O
.(5)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则该有机物的最简式为
CH2O
CH2O
.(6)要确立该有机物的分子式,还要知道
有机物的相对分子质量
有机物的相对分子质量
.某研究性学习小组为探究铝与饱和氯化铜溶液的反应,设计实验探究方案如下:
(一)实验用品:纯铝片、饱和氯化铜溶液
(二)实验记录:
(三)背景资料:纳米铜粉呈紫色至黑色
(四)请你根据所学知识参与并完成该实验的以下探究、拓展及应用:
(1)在一段时间内气泡产生越来越快的主要原因是: (填写一个即可).
(2)该实验中有少量蓝色悬浊液和大量气体生成的原因是(用离子方程式表示): .
(3)该小组设计实验对反应进行一段时间后的混合液体进行分离、提纯,以得到纯净的AlCl3和CuCl2.实验步骤如图:
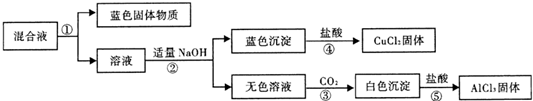
请你完成:
1)在①、②、③中进行的实验操作均相同,其名称是 .
2)操作②中生成无色溶液的化学方程式为 .
3)以下是操作④、⑤制取无水AlCl3和CuCl2固体的部分装置(铁架台、加热装置等已略去)
i.该装置如下图,装置a由 、圆底烧瓶、双孔塞和导管组成.
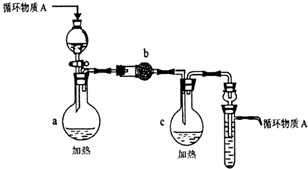
ii.无水AlCl3和CuCl2是在装置c中制得的,但需在氯化氢存在的条件下进行该操作,目的是 .
(4)请你选用中学化学中常用药品(试剂),填写下表,完成该小组探究反应过程中铝表面的黑色物质的实验方案.(提示:该小组同学猜想可能是Cu或CuO或两种混合物)
查看习题详情和答案>>
(一)实验用品:纯铝片、饱和氯化铜溶液
(二)实验记录:
| 1.将铝片放入饱和氯化铜溶液中,反应较快,浸在溶液中的铝片表面迅速生成蓬松的红色固体,同时在液面处的铝片以及有液体飞溅到上部的铝片表面有黑色物质生成.2.有大量气泡产生,在一段时间内产生气泡越来越快,将其收集并点燃发出爆鸣声.3.有少量蓝色悬浊液产生. |
(四)请你根据所学知识参与并完成该实验的以下探究、拓展及应用:
(1)在一段时间内气泡产生越来越快的主要原因是:
(2)该实验中有少量蓝色悬浊液和大量气体生成的原因是(用离子方程式表示):
(3)该小组设计实验对反应进行一段时间后的混合液体进行分离、提纯,以得到纯净的AlCl3和CuCl2.实验步骤如图:

请你完成:
1)在①、②、③中进行的实验操作均相同,其名称是
2)操作②中生成无色溶液的化学方程式为
3)以下是操作④、⑤制取无水AlCl3和CuCl2固体的部分装置(铁架台、加热装置等已略去)
i.该装置如下图,装置a由

ii.无水AlCl3和CuCl2是在装置c中制得的,但需在氯化氢存在的条件下进行该操作,目的是
(4)请你选用中学化学中常用药品(试剂),填写下表,完成该小组探究反应过程中铝表面的黑色物质的实验方案.(提示:该小组同学猜想可能是Cu或CuO或两种混合物)
| 预设验证方法 | 猜想的现象 | 结论 |
| 取适量覆盖有黑色物质的铝片于试管中, |
黑色物质含铜,可能是纳米铜 |
 (2011?武汉模拟)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(2011?武汉模拟)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:(一)制取氧化铜
①称取2gCuSO4?5H2O研细后倒入烧杯,加10mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用.
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是
①②③
①②③
(填实验序号),步骤①、③中研磨固体所用仪器的名称是研钵
研钵
;(2)步骤③中洗涤沉淀的操作是
沿玻璃棒向漏斗中沉淀加蒸馏水至浸没沉淀,待水自然流出后,重复2-3次,
沿玻璃棒向漏斗中沉淀加蒸馏水至浸没沉淀,待水自然流出后,重复2-3次,
.(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,用右图装置进行实验,实验时均以生成25mL气体为准,其它可能影响实验的因素均已忽略,相关数据见表:
| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
| ④ | 1.2g | 无其他物质 | |
| ⑤ | 1.2g | CuO 0.5g | |
| ⑥ | 1.2g | MnO2 0.5g |
(3)上述实验中的“待测数据”指
产生25mL气体所需时间
产生25mL气体所需时间
;(4)本实验装置图中量气装置B由干燥管、乳胶管和50mL滴定管改造后组装而成,此处所用滴定管是
碱式
碱式
(填“酸式”或“碱式”)滴定管;(5)若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,
用带火星的木条靠近,若复燃则证明收集的气体是氧气.
用带火星的木条靠近,若复燃则证明收集的气体是氧气.
;(6)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.
检测CuO反应前后质量是否改变
检测CuO反应前后质量是否改变
,b.CuO的化学性质有没有改变.制取纯净的氯化铜晶体(CuCl2?2H2O)的生产过程如下:
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2.
II.对I中所得到的溶液按下列步骤进行提纯.
已知:
试回答下列问题:
(1)下列物质中,最适合作为氧化剂X的是
A.KMnO4 B.K2Cr2O4 C.H2O2 D.NaClO
(2)①加入的物质Y是
(3)分离出沉淀Z,并将滤液蒸发,欲获得氯化铜晶体(CuCl2?2H2O),应采取的措施是
(4)①某同学利用反应:Cu+2H+═Cu2++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为
(5)已知一些难溶物的浓度积常数如下表:
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的
①NaOH ②FeS ③Na2S.
查看习题详情和答案>>
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2.
II.对I中所得到的溶液按下列步骤进行提纯.

已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(1)下列物质中,最适合作为氧化剂X的是
C
C
.(填序号)A.KMnO4 B.K2Cr2O4 C.H2O2 D.NaClO
(2)①加入的物质Y是
CuO或Cu(OH)2或CuCO3
CuO或Cu(OH)2或CuCO3
.②写出沉淀Z在水中的沉淀溶解平衡方程式:Fe(OH)3(s) Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq)
 Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq)Fe(OH)3(s) Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq)
. Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq)(3)分离出沉淀Z,并将滤液蒸发,欲获得氯化铜晶体(CuCl2?2H2O),应采取的措施是
在HCl气流下加热浓缩,冷却结晶
在HCl气流下加热浓缩,冷却结晶
.(4)①某同学利用反应:Cu+2H+═Cu2++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为
电解池
电解池
.(填“原电池”或“电解池”)②请你在下面方框中画出该同学设计的装置图,并指明电极材料和电解质溶液.(5)已知一些难溶物的浓度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
②
②
除去它们.(选填序号)①NaOH ②FeS ③Na2S.