摘要:13.工业上根据NaHCO3溶解度比NaCl.Na2CO3.NH4HCO3.NH4Cl都小的性质.运用CO2 + NH3 + H2O + NaCl = NaHCO3↓+ NH4Cl的反应原理.最终可制备纯碱.下面是在实验室进行模拟实验的生产流程示意图: 气体A的饱和溶液加入食盐ⅠA和食盐的饱和溶液通入足量气体BⅡ悬浊液过滤Ⅲ晶体Ⅳ纯碱 则下列叙述错误的是 A.A气体是NH3.B气体是CO2 B.第Ⅲ步得到的晶体是发酵粉的主要成分 C.第Ⅲ步操作用到的主要玻璃仪器是烧杯.漏斗.玻璃棒 D.第Ⅳ步操作的主要过程有溶解.蒸发.结晶
网址:http://m.1010jiajiao.com/timu3_id_384831[举报]
工业上制纯碱是根据NaHCO3溶解度比NaCl、Na2CO3、NH4Cl、NH4HCO3都小的性质,在适宜温度下运用:CO2+NH3+H2O+NaCl→NaHCO3+NH4Cl等反应原理制取的。欲在实验室通过上述过程和其它的必要反应制取纯碱,可用下列图示中的①②③④几个步骤,其中A、B分别代表CO2和NH3之一。
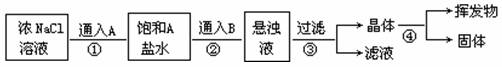
(1)操作③所得到的晶体是下列的____;
A.NH4Cl B.NaHCO3 C.Na2CO3 D.NH4HCO3
(2)对于上述过程,下列叙述正确的是 。
A.气体A是CO2,气体B是NH3
B.气体A是NH3,气体B是CO2
C.步骤④是加热
D.①②两步操作的顺序与两种气体溶解度有重要的关系,不能颠倒
查看习题详情和答案>>