网址:http://m.1010jiajiao.com/timu3_id_384753[举报]
【实验步骤】
(1)用_______(填仪器名称,下同)准确称量瓷坩埚的质量。
(2)在瓷坩埚中加入约2 g研细的硫酸铜晶体,并称量。
(3)把盛有硫酸铜晶体的瓷坩埚放在泥三角上慢慢加热,直到蓝色完全变白,然后把坩埚移至____________中冷却到室温,并称量。
(4)重复(3)的实验进行恒重操作,直至两次称量结果相差不超过0.001 g。
【数据记录与处理】
| | 第一次实验 | 第二次实验 |
| 坩埚的质量(g) | 29.563 | 30.064 |
| 坩埚+试样的质量(g) | 31.676 | 32.051 |
| 恒重后,坩埚+硫酸铜的质量(g) | 30.911 | 31.324 |
| x的值 | 5.05 | 5.13 |
根据上表中的数据处理结果,计算本次实验的相对误差为______%(已知x的理论值为5)。
【分析与讨论】
(1)做一次实验,至少需要加热________次(填数字,下同);至少需要称量_________次。
(2)恒重操作的目的是__________________。
(3)重复两次实验求x平均值的目的是_____________________________。
(4)实验值比理论值偏大的原因可能是________(填编号)。
a.加热过程中有晶体溅出 b.被测样品中含有加热不挥发的杂质
c.实验前,晶体表面潮湿 d.晶体灼烧后直接放在空气中冷却
加热前质量 加热后质量
m1(容器) m2(容器+晶体) m3(容器+无水CuSO4
5.4g 7.9g 6.8g
(1)请写出结晶水含量(质量分数w)的计算公式(用m1、m2、m3表示)w(H2O)=________。
(2)该生测定结晶水的含量是偏低还是偏高________。
(3)从下列分析中选出该生实验误差的原因可能是________。
A.加热前称量时,容器未完全干燥
B.最后两次加热后的质量差较大(大于0.1g)
C.加热后容器未放入干燥器中冷却
D.加热过程中晶体有少量溅失
查看习题详情和答案>>
实验室中测定硫酸铜晶体结晶水含量,某学生实验后得到以下数据:
加热前质量 加热后质量
m1(容器) m2(容器+晶体) m3(容器+无水CuSO4
5.4g 7.9g 6.8g
(1)请写出结晶水含量(质量分数w)的计算公式(用m1、m2、m3表示)w(H2O)=________。
(2)该生测定结晶水的含量是偏低还是偏高________。
(3)从下列分析中选出该生实验误差的原因可能是________。
A.加热前称量时,容器未完全干燥
B.最后两次加热后的质量差较大(大于0.1g)
C.加热后容器未放入干燥器中冷却
D.加热过程中晶体有少量溅失
查看习题详情和答案>>
(1)在硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行 次。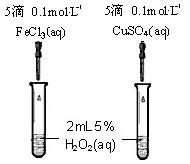
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、 、 。
(3)下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。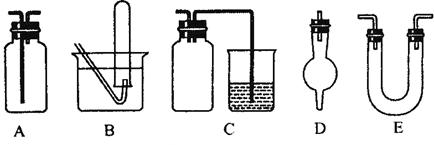
请回答下列问题:
①能用作干燥氨气的装置有_______________(填字母);
②既能用于收集氯气又能用于收集一氧化氮气体的装置有_______________(填字母);
③在实验室制备氯气的实验中,用以除去氯气中氯化氢等杂质气体的装置有________________ (填字母);
④能用于乙烯与溴水反应制二溴乙烷的实验装置有___________________(填字母);
⑤在C装置中,若用烧杯内的氢氧化钠溶液吸收尾气二氧化硫,则广口瓶的作用是___________________。
(4)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了右图所示的实验。
①可通过观察 来定性的得出结论;
②有A同学提出将CuSO4改为CuCl2更为合理,其理是 ;
若不采用A同学的改进方案,你认为还可以如何改进? 。
某实验小组为研究草酸的制取和草酸的性质,进行如下实验。
实验I:制备草酸
实验室用硝酸氧化淀粉水解液制备草酸的装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:
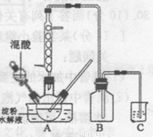
①将一定量的淀粉水解液加人三颈瓶中
②控制反应液温度在55〜600C条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸 (65%HNO3与98%H2S04的质量比为2 :1.5)溶液
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2↑+8NO↑+10H2O
3 H2C2O4+2HNO3→6CO2↑+2NO↑+4H2O
(1)检验淀粉是否水解完全所需用的试剂为________。
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是________。
实验II :草酸晶体中结晶水测定
草酸晶体的化学式可表示为H2C2O4 • xH2O,为测定x的值,进行下列实验:
①称取6.3g某草酸晶体配成100.0mL的水溶液。
②取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0. 5mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4 的体积为10.00mL。回答下列问题:
(3)写出上述反应的离子方程式________________。
(4)计算x=________。
(5)滴定时,常发现反应速率开始很慢,后来逐渐加快,可能的原因是________。
实验III:草酸不稳定性
查阅资料:草酸晶体(H2C2O4 •xH20),1000C开始失水,100.5℃左右分解产生H2O、CO和CO2。请用下图中提供的仪器及试剂,设计一个实验,证明草酸晶体分解得到的混合气中有H2O、CO和CO2 (加热装置和导管等在图中略去,部分装置可重复使用)。

回答下列问题:
(6)仪器装置按连接顺序为________。
(7)仪器B中无水硫酸铜的作用________。
(8)能证明混合气中含有CO的实验依据是________。
查看习题详情和答案>>