摘要:7.能实现Al3+ + 3AlO2– + 6H2O → 4Al(OH)3↓过程的是----------( ) A.向铝盐溶液中不断滴加NaOH溶液 B.向偏铝酸盐溶液中不断加入盐酸 C.向NaAlO2溶液中不断通入CO2气体 D.向NaOH溶液中不断滴加铝盐溶液
网址:http://m.1010jiajiao.com/timu3_id_384750[举报]
能实现3AlO2-+Al3++6H2O═4Al(OH)3↓过程的是( )
A.向铝盐溶液中不断滴加氢氧化钠溶液
B.向偏铝酸钠溶液中不断滴加盐酸溶液
C.向偏铝酸钠溶液中不断通入CO2气体
D.向氢氧化钠溶液中不断滴加铝盐溶液
查看习题详情和答案>>
A.向铝盐溶液中不断滴加氢氧化钠溶液
B.向偏铝酸钠溶液中不断滴加盐酸溶液
C.向偏铝酸钠溶液中不断通入CO2气体
D.向氢氧化钠溶液中不断滴加铝盐溶液
查看习题详情和答案>>
(2012?南开区一模)图中B、F为单质,其他为化合物,它们之间存在如下转化关系(部分反应物、生成物及反应条件已略去).其中,A、C是工业上用途很广的两种重要化工原料,C的焰色反应为黄色,B为日常生活中常见的金属,H、G分子均具有正四面体结构,H是一种重要的能源.J是一种较好的耐火材料,K是极易溶于水的碱性气体,请回答下列问题:
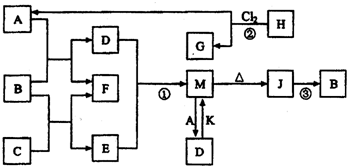 (1)C中存在的化学键类型为
(1)C中存在的化学键类型为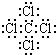
 .
.
(2)反应②进行的条件
(3)反应①的离子方程式为
反应③的化学方程式为为
(4)向D溶液中通入K可生成M和另一种物质X,写出鉴定X中阳离子的实验方法和现象为
(5)碘和氯的原子序数之差为36,放射性131的原子核内中子数为
(6)我国首创的海洋电池以B单质为负极,铂网为正极,海水为电解质溶液,空气中的氧气与B反应产生电流.该电池的正极反应式为
查看习题详情和答案>>
 (1)C中存在的化学键类型为
(1)C中存在的化学键类型为离子键和共价键
离子键和共价键
;G的电子式为

(2)反应②进行的条件
光照、过量氯气
光照、过量氯气
.(3)反应①的离子方程式为
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.反应③的化学方程式为为
2Al2O3(熔融)
4Al+3O2↑
| ||
| 冰晶石 |
2Al2O3(熔融)
4Al+3O2↑
.
| ||
| 冰晶石 |
(4)向D溶液中通入K可生成M和另一种物质X,写出鉴定X中阳离子的实验方法和现象为
取少量X溶液于试管中,用胶头滴管滴入NaOH溶液,将湿润的红色石蕊试纸置于试管口,加热试管,可观察到红色石蕊试纸变蓝
取少量X溶液于试管中,用胶头滴管滴入NaOH溶液,将湿润的红色石蕊试纸置于试管口,加热试管,可观察到红色石蕊试纸变蓝
.(5)碘和氯的原子序数之差为36,放射性131的原子核内中子数为
78
78
,碘在元素周期表中的位置为第五周期第ⅦA族
第五周期第ⅦA族
.(6)我国首创的海洋电池以B单质为负极,铂网为正极,海水为电解质溶液,空气中的氧气与B反应产生电流.该电池的正极反应式为
O2+2H2O+4e-=4OH-(或3O2+6H2O+12e-=12OH-)
O2+2H2O+4e-=4OH-(或3O2+6H2O+12e-=12OH-)
.有位于周期表前四周期的A、B、C、D、E、F六种元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、E分别是同主族元素,且B、E两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍.处于同周期的C、D、E三种元素中,D是该周期金属元素中金属性最弱的元素.F元素形成的氧化物有多种,其中之一为红棕色粉末W.
(1)化合物X是由A、B、C形成的,其晶体类型为
 ;
;
(2)写出W物质的一种用途
(3)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的化学方程式
(4)化合物M由B、D、E三种元素形成,将M溶液逐滴加入到X溶液中,实验的主要现象是
写出有关反应的离子方程式
(5)D单质、F单质和X溶液能构成原电池,写出该原电池负极电极反应式样
(6)通常条件下,C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol和稀溶液间反应放出的热量为114.6KJ,试写出表示该热量变化的离子方程式
(7)将agD单质、F单质及D、F的氧化物样品溶解在过量的100mL pH=1的E最高价氧化物对应水化物的溶液中,然后向其中加入X溶液使D、F离子刚好完全沉淀,用去X溶液50mL,则X溶液的物质的量浓度为
(8)B与C形成的化合物Y呈淡黄色,Y与F的硫酸盐(纯净物)按物质的量之比1:2混合溶于水中,反应的离子方程式可能为
查看习题详情和答案>>
(1)化合物X是由A、B、C形成的,其晶体类型为
离子晶体
离子晶体
,其阴离子的电子式为

(2)写出W物质的一种用途
炼铁原料或油漆的原料等
炼铁原料或油漆的原料等
;(3)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的化学方程式
NaHSO4+NaHSO3═Na2SO4+SO2↑+H2O
NaHSO4+NaHSO3═Na2SO4+SO2↑+H2O
;(4)化合物M由B、D、E三种元素形成,将M溶液逐滴加入到X溶液中,实验的主要现象是
先无沉淀,后出现白色沉淀,且不消失
先无沉淀,后出现白色沉淀,且不消失
,写出有关反应的离子方程式
Al3++4OH-═AlO2-+2H2O
Al3++4OH-═AlO2-+2H2O
Al3++3AlO2-+6H20═4Al(OH)3↓
Al3++3AlO2-+6H20═4Al(OH)3↓
;(5)D单质、F单质和X溶液能构成原电池,写出该原电池负极电极反应式样
Al-3e-+4OH-═AlO2-+2H2O
Al-3e-+4OH-═AlO2-+2H2O
;(6)通常条件下,C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol和稀溶液间反应放出的热量为114.6KJ,试写出表示该热量变化的离子方程式
H+(aq)+OH-(aq)═H20(l)△H=-57.3KJ/mol
H+(aq)+OH-(aq)═H20(l)△H=-57.3KJ/mol
.(7)将agD单质、F单质及D、F的氧化物样品溶解在过量的100mL pH=1的E最高价氧化物对应水化物的溶液中,然后向其中加入X溶液使D、F离子刚好完全沉淀,用去X溶液50mL,则X溶液的物质的量浓度为
0.2
0.2
mol?L-1.(8)B与C形成的化合物Y呈淡黄色,Y与F的硫酸盐(纯净物)按物质的量之比1:2混合溶于水中,反应的离子方程式可能为
3Na2O2+6Fe2++6H2O═6Na++4Fe(OH)3↓+2Fe3+;6Na2O2+4Fe3++6H2O═12Na++4Fe(OH)3↓+3O2↑
3Na2O2+6Fe2++6H2O═6Na++4Fe(OH)3↓+2Fe3+;6Na2O2+4Fe3++6H2O═12Na++4Fe(OH)3↓+3O2↑
.