网址:http://m.1010jiajiao.com/timu3_id_384739[举报]
(1) 实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30—35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。
![]() 四种盐在不同温度下的溶解度(g / 100 g水)表
四种盐在不同温度下的溶解度(g / 100 g水)表
|
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
请回答: ![]()
![]()
![]()
![]()
![]() ①反应控制在30—35℃,是因为高于35℃NH4HCO3会分解,低于30℃则反应速率降低 ,为控制此温度范围,通常采取的加热方法为 ;
①反应控制在30—35℃,是因为高于35℃NH4HCO3会分解,低于30℃则反应速率降低 ,为控制此温度范围,通常采取的加热方法为 ;
![]() ②加料完毕,保温30分钟,目的________________________ ;
②加料完毕,保温30分钟,目的________________________ ;
![]() ③静置后只析出NaHCO3晶体的原因__________________________ ;
③静置后只析出NaHCO3晶体的原因__________________________ ;
![]() ④过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使 _________(填化学式)循环使用,回收得到NH4Cl晶体。
④过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使 _________(填化学式)循环使用,回收得到NH4Cl晶体。
![]() (2)我国科学家侯德榜改革国外的纯碱生产工艺,使其更加先进,被称为侯德榜制碱法,生产流程为:
(2)我国科学家侯德榜改革国外的纯碱生产工艺,使其更加先进,被称为侯德榜制碱法,生产流程为:
![]()
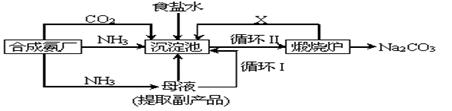
![]() ⑤沉淀池中反应的化学方程式: _______-_______ __ ;
⑤沉淀池中反应的化学方程式: _______-_______ __ ;
![]() ⑥检验产品碳酸钠中是否含有氯化钠的操作方法为: 。
⑥检验产品碳酸钠中是否含有氯化钠的操作方法为: 。
![]() ⑦循环(I)中应该加入或通入物质的化学式为 。
⑦循环(I)中应该加入或通入物质的化学式为 。
NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl
2NaHCO3
某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如下一套实验装置:

实验室可供选用的药品有:浓氨水、纯碱、大理石、稀盐酸、稀硫酸、熟石灰、氯化铵、氯化钠。
(1)A、D中最合适的试剂为:A_______;D_______。(填名称)
(2)本实验在具体操作过程中,应先通_________气体,再通________气体,原因是________________。
(3)指出该装置中的错误_________。(至少两处)
(4)在改进装置后,该同学进行了实验,实验所用的饱和NaCl溶液中含溶质58.5g,实验最后得到无水碳酸钠26.0g,则其产率为________;该同学针对其实验结果,认真分析了造成损失的原因,发现其操作步骤并没有错误,则主要原因是________________________。
(5)在侯氏制碱法工业生产中,原料的利用率高,大大降低了成本。请问本实验中哪些物质可重复利用?________________。 查看习题详情和答案>>
NaCl(饱和)+NH3+CO2+H2O===NaHCO3↓+NH4Cl;2NaHCO3
 Na2CO3+CO2↑+H2O。某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如图所示的一套实验装置:
Na2CO3+CO2↑+H2O。某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如图所示的一套实验装置: 
(1)A、D中最合适的试剂为:A________;D________(填名称)。
(2)本实验具体操作过程中,应先通入________气体,再通入________气体;原因是_________________________________________________________________。
(3)指出该装置中的错误(至少两处)__________________________________________ 。
(4)在改进装置中,该兴趣小组同学进行了实验,实验所用的饱和NaCl溶液中含溶质58.5 g,实验最后得到无水碳酸钠26.0 g,则其产率为________;该兴趣小组同学针对其实验结果,认真分析了造成损失的原因,发现其操作步骤并没有错误,则主要原因是_______________________________________________。
(5)在“侯氏制碱法”工业生产中,原料的利用率高,大大降低了成本.请问本实验中哪些物质可重复利用?____________。
工业制备纯碱的方法是氨碱法.其主要过程是:
①冷却时将氨气通入食盐水,制得饱和的氨化盐水;②在加压时通入CO2,发生反应:
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
然后将滤出的小苏打焙烧制得纯碱:
2NaHCO3 Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
母液中的NH4Cl可加入Ca(OH)2回收氨,反应为:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O,但大量生成的CaCl2用途不大,难以处理.1942年我国化学家侯德榜发明了侯氏制碱法,对氨碱法进行了改进.他将析出NaHCO3后的母液于5~10℃加入食盐粉末,使原来不易结晶的NH4Cl析出晶体,供化肥和其他工业使用.侯氏制碱法成为世界上生产纯碱的重要方法.通过上面资料回答:
(1)氨碱法除回收NH3循环使用外,还有哪些物质可回收使用?
(2)侯氏制碱法除不必生产难以处理的CaCl2外,从原料NaCl的利用上分析,最主要的显著优点为________________________________________.
(3)氨碱法及侯氏制碱法都要用到有关物质的溶解度数据,现列出下表:(单位:g/100g H2O)

a.为什么侯氏制碱法使NH4Cl晶体析出选在5~10℃?
b.氨碱法在②中反应温度在20℃左右,为什么会有NaHCO3晶体析出?
查看习题详情和答案>>我国著名化学家侯德榜先生发明的“侯氏制碱法”,因原料利用率高,并能进行连续生产,从而享誉中内外.“侯氏制碱法”的基本做法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱.它的反应原理可用下列化学方程式表示:
NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl
2NaHCO3Na2![]() CO3+CO2+H2O
CO3+CO2+H2O
某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如下一套实验装置

实验室可选药品有浓氨水、纯碱、大理石、稀盐酸、稀硫酸、熟石灰、氯化铵、氯化钠
(1)选用最合适的试剂的名称D________
(2)本实验具体操作过程中,应先通________气体,再通________气体;
(3)指出该装置的三处错误________ ________ ________
(4)在改进装置后,该同学进行了实验,实验所用的饱和NaCl溶液中含溶质58.5 g,实验最后得到无水碳酸钠26 g,则其产率为________;该同学针对其实验结果,认真分析了造成损失的原因,发现其操作步骤并没有错误,则主要原因是________
(5)在“侯氏制碱法”的工业生产中,原料的利用率高,大大降低了成本.请问本实验中哪些物质可重复利用?________