摘要:25.有A气体和B气体在一定条件下在一密闭容器中发生如下反应: A2C (1)写出该反应的化学平衡常数表达式K= . (2)升高温度.该反应的正反应速率(v正) .逆反应速率(v逆) .K值 . 气体C的百分含量 .(以上均填“增大 .“减小 或“不变 ) (3)若增大压强.A的转化率 ,若已达平衡后再加入A.A的转化率 .C% .(以上均填“增大 .“减小 或“不一定 ) (4)若加压到10×101.3 KPa时.其它条件不变.发现平衡逆向移动.原因应该是 A.由于体积变大了.反应朝着体积增大方向移动 B.由于A状态发生了变化 C.由于体积变小了.反应朝着体积增大方向移动 D.由于A和B的状态都发生了变化 E.由于B状态发生了变化.A状态可能发生了变化也可能没有变化 (5)下图表示上述反应在某一时间段中反应速率与反应过程的关系图.由图判断.C的百分含量最高的一段时间是 . (6)据图判断反应在t2~t3这段时间内.曲线变化的原因是 .t5~t6时间内曲线变化的原因可能是 . A.加了催化剂 B.扩大容器的体积 C.降低温度 D.增大压强
网址:http://m.1010jiajiao.com/timu3_id_384737[举报]
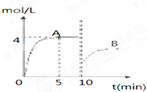 在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.(1)反应到5min时,氢气反应速率
1.2mol/(L?min)
1.2mol/(L?min)
.A的平衡常数为| 16 |
| (a-2)×(b-4)3 |
| 16 |
| (a-2)×(b-4)3 |
(2)在10min时采取的措施是
移走生成的氨气,降低氨气的浓度
移走生成的氨气,降低氨气的浓度
;(3)-50°C时,液氨存在如下电离:2NH3?NH4++NH-2,K=2×10-12,往液氨中加入NH4Cl固体,K
=
=
2×10-12(填“<”、“>”或“=”)(4)已知2A2(g)+B2(g)═2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ.若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量c kJ,a、b、c之间满足何种关系
b+c=a
b+c=a
(用代数式表示) 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题:(1)温度T1
>
>
T2(填“>”“=”或“<”).(2)正反应是
放热
放热
反应(填“吸热”或“放热”).(3)如果A、B、C均为气体,则m
>
>
2(填“>”“=”或“<”).(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强
增大
增大
(填“增大”“减小”或“不变”),平衡不
不
移动(填“向正反应方向”“向逆反应方向”或“不”).(5)已知2A(g)+B(g)?2C(g)△H=-a kJ?mol-1(a>0),在一个有催化剂的固定容积的容器中加入2mol A和1mol B,在500℃时充分反应达平衡后C的浓度为ω mol/L,放出热量b kJ.
①a
>
>
b(填“>”“=”或“<”).②若将反应温度升高到700℃,该反应的平衡常数将
减小
减小
(填“增大”“减小”或“不变”).③在上述容器中为使该反应的反应速率增大,且平衡向正反应方向移动的可采取的措施是
增大A2的浓度,或增大B2的浓度或同时增大A2、B2的浓度
增大A2的浓度,或增大B2的浓度或同时增大A2、B2的浓度
(说出一种即可)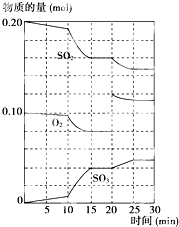 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0(1)降低温度,该反应K值
增大
增大
,二氧化硫转化率增大
增大
,化学反应速率减小
减小
.(以上均填“增大”“减小”或“不变”)(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间有
15-20min、25-30min
15-20min、25-30min
.(3)据上图判断,反应进行至20min时,曲线发生变化的原因是
增大氧气的浓度
增大氧气的浓度
(用文字表达);10min到15min的曲线变化的原因可能是ab
ab
(填写编号).a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量.
在一定条件下,将3molA 和1mol B 两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol?L-1.请填空:
(1)x=
(2)温度降低,K值增大,则正反应是
(3)B的转化率为
(4)能判断该反应达到平衡状态的依据是
A.混合气体的密度不变
B.容器中的压强不再变化
C.生成D的反应速率是生成B的反应速率的2倍
D.单位时间内生成3molA,同时生成1molB.
查看习题详情和答案>>
(1)x=
1
1
(有过程)(2)温度降低,K值增大,则正反应是
放热
放热
(填“放热”或“吸热”)反应.(3)B的转化率为
40%
40%
(有过程).(4)能判断该反应达到平衡状态的依据是
BC
BC
(填编号)A.混合气体的密度不变
B.容器中的压强不再变化
C.生成D的反应速率是生成B的反应速率的2倍
D.单位时间内生成3molA,同时生成1molB.
 在一定条件下,某些化学反应可以用如图框架表示,根据要求回答下列问题:
在一定条件下,某些化学反应可以用如图框架表示,根据要求回答下列问题:(1)若A、C、D均为含氯物质,且A的化合价介于C和D之间,D具有漂白性,写出该反应的离子方程式
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
;(2)若通过电解的方法获得黄绿色气体C,则该反应的离子方程式为
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
(3)若C、D均为气体且均能使澄清石灰水变浑浊,写出符合上述框图要求的化学方程式
C+2H2SO4(浓)
CO2↑+SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+SO2↑+2H2O
| ||
(4)若A为红色金属单质,B为第二周期某种元素的最高价氧化物的水化物的稀溶液,
写出符合上述框图关系的离子方程式
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.