网址:http://m.1010jiajiao.com/timu3_id_384429[举报]
(07年广东文基·62)下列说法正确的是
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.水力发电是将化学能转化为电能的过程
查看习题详情和答案>>(07年广东理科基础卷)下列关于煤、石油、天然气等资源的说法正确的是()
A.石油裂解得到的汽油是纯净物
B.石油产品都可用于聚合反应
C.天然气是一种清洁的化石燃料
D.水煤气是通过煤的液化得到的气体燃料
查看习题详情和答案>>(07年广东卷)为了避免青铜器生成铜绿,以下方法正确的是( )
A. 将青铜器放在银质托盘上
B. 将青铜器保存在干燥的环境中
C. 将青铜器保存在潮湿的空气中
D. 在青铜器的表面覆盖一层防渗的高分子膜
查看习题详情和答案>>
(07年广东卷)(12分)羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料。其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
3种钙盐的溶解度随溶液pH的变化如下图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3?H2O=Ca5(PO4)3OH↓+ +
②5Ca(OH)2+3H3PO4=
(2)与方法A相比,方法B的优点是 。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是_____________;
(4)图中所示3种钙盐在人体中最稳定的存在形式是 (填化学式)。
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因有______。

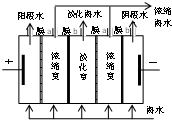 (2009?肇庆一模)海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
(2009?肇庆一模)海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )