网址:http://m.1010jiajiao.com/timu3_id_384379[举报]
(1)下表是空气中部分气体的沸点.将空气液化加热分馏,依据下表数据判断,最先气化得到的气体是
| 气体名称 | 氨气 | 氧气 | 氦气 | 氖气 | 氩气 | 氪气 | 氚气 |
| 沸点/℃ | -196 | -183 | -269 | -264 | -186 | -153 | -108 |
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J?t-1 | 28×109 | 38×109 | 48×109 |
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
| ||
| 高温 |
| ||
| 高温 |
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ?mol-1;
2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ?mol-1;
试写出由C于水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
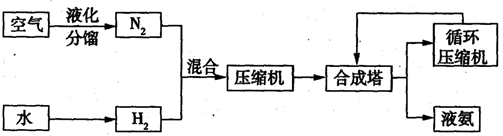
(3)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据.
| NH3含量% 压强/MPa 温度/℃ |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
 2NH3的△H
2NH3的△H②该反应的化学平衡常数表达式为
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的
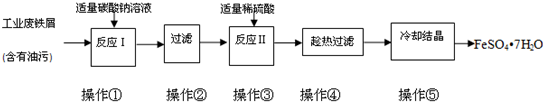
(1)操作①中碳酸钠溶液能除去油污,原因是
(2)下列物质分离方法的原理与过滤相同的是
a.蒸馏 b.分液
c.渗析 d.重结晶
(3)FeSO4?7H2O是某些补血剂的主要成分,实验室中为测定某补血剂中铁元素的含量,进行了以下实验:
①配制100mL 1.00×10-2mol?L-1的KMnO4溶液,所用的仪器有天平、烧杯、胶头滴管及
a.KMnO4溶于水不放热,可以直接在容量瓶中溶解
b.容量瓶洗涤后不需干燥即可直接用于实验
c.定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平
d.如果定容时加水超过刻度线必须重新配制
②取2.0g克该补血剂配成溶液,进行预处理,使其中的铁元素全都是Fe2+,再用配制好的标准KMnO4溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O.进行滴定时,标准KMnO4溶液应该盛放在
③滴定结束时,消耗浓度为1.00×10-2mol?L-1的标准KMnO4溶液26.00mL,则该补血剂中铁元素的含量为
 -C2H5)可生产塑料单体苯乙烯(
-C2H5)可生产塑料单体苯乙烯( -CH=CH2),其原理反应是:
-CH=CH2),其原理反应是: -C2H5(g)
-C2H5(g) 
 -CH=CH2(g)+H2(g);△H=+125kJ?mol-1.某温度下,将0.40mol
-CH=CH2(g)+H2(g);△H=+125kJ?mol-1.某温度下,将0.40mol  -C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
-C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表: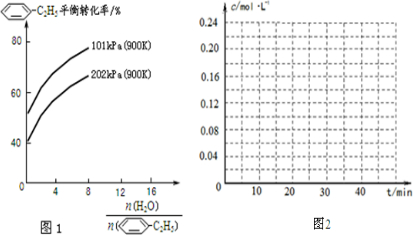
| 时间/min | 0 | 10 | 20 | 30 | 40 |
n( -C2H5)/mol -C2H5)/mol |
0.40 | 0.30 | 0.26 | n2 | n3 |
n( -CH=CH2)/mol -CH=CH2)/mol |
0.00 | 0.10 | n1 | 0.16 | 0.16 |
(2)工业上常以高温水蒸气作为反应体系的稀释剂(不参与反应).
 -C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将
-C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将(3)副产物H2用做氢氧燃料电池.写出酸性条件下,该电池正极的电极反应式
(4)在相同条件下,若最初向该容器中充入
 -CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下
-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下  -C2H5(g)和
-C2H5(g)和 -CH=CH2(g)的浓度c随时间t变化的曲线
-CH=CH2(g)的浓度c随时间t变化的曲线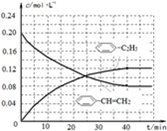

某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如图2-26所示。该实验的主要操作步骤如下:

图2-26
①配制浓度均为1 mol·L-1 盐酸和醋酸溶液;
②用_________量取10.00 mL 1 mol·L-1 盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为_________;
④在广口瓶中装足量的水,按图连接好装置,检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全,记录_____________________________;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应___________________________________,读出量筒中水的体积为V mL。
请将上述步骤补充完整并完成下列问题:
(1)用文字表述④检查该装置气密性的操作与观察方法:_______________________________。
(2)本实验中应选用______________(填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(3)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:
Vm=_________________。
(4)上述速率不等的原因是_______________________________________________________,
铜丝不与酸接触的原因是_______________________________________________________。
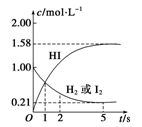
查看习题详情和答案>> 2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。