摘要:252006年5月15日国家食品药品监督管理局通报了齐齐哈尔第二制药有限公司假药案的情况.“齐二药 违反规定.购入工业用“二甘醇 (化学式为C4H10O3)代替医用丙二醇(化学式为C3H8O3)作辅料.用于“亮菌甲素 注射液的生产.导致病人肾功能急性衰竭.造成多人死亡.二甘醇又称乙二醇醚.分子式C4H10O3 (HO-CH2-CH2-O-CH2-CH2-OH).以二甘醇为原料.可制取醚.酸.酯.胺等多种化工产品.其主要产品有吗啉及其衍生物1.4-二恶烷.二甘醇单(双)醚.二甘醇酯类等.被广泛应用于石油化工.橡胶.塑料.纺织.涂料.粘合剂.制药等行业.用途十分广泛.二甘醇一般的合成路线为: 请回答下列问题: 过程1是石油加工中常用步骤.其名称为 . (2)从物质B到物质C的过程如果条件控制不好会生成另一种物质E.E可用于金属的气割和氧气焊.则为了能得到二甘醇D.物质B到物质C的反应条件是 ,该反应属于 . (3)物质D就是二甘醇.则合成路线中的物质A.B.C的结构简式分别为: A: .B: .C: . (4)反应1的化学方程式为: .
网址:http://m.1010jiajiao.com/timu3_id_384378[举报]
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):


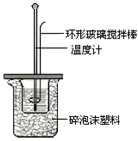
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g?℃).则中和热△H=
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
查看习题详情和答案>>
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体
5.0
5.0
g.(2)从图中选择称量NaOH固体所需要的仪器是(填字母):
a b e
a b e
.

Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):
H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6kJ/mol
H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6kJ/mol
.(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
|
温度 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
-53.5 kJ/mol
-53.5 kJ/mol
(取小数点后一位).③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)
acd
acd
.a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol/L NaOH溶液(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体
(2)称量NaOH固体所需要的仪器是下列的
①托盘天平、②小烧杯、③坩锅钳、④玻棒、⑤药匙、⑥量筒
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)碎泡沫塑料的作用是
(2)写出该反应的热化学方程式为(中和热为57.3kJ/mol):
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.3 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.0 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)
a.装置保温、隔热效果差;
b.量取NaOH溶液的体积时仰视读数;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液测定中和热.测定中和热的实验装置如图1所示.
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,数据如下表所示:
①请填写下表中的空白:
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g?℃).则生成1molH2O的△H=
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是
①室温低于10℃时进行实验,②在量取NaOH溶液的体积时仰视读数,③分多次把NaOH溶液倒入盛有硫酸的小烧杯中,④实验时用环形铜丝搅拌棒代替环形玻璃搅拌棒.
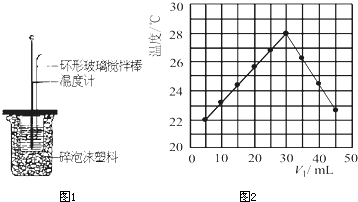
(3)将V1mL 0.4mol/L H2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL).下列叙述正确的是
A 做该实验时环境温度为22℃
B 该实验表明化学能可转化为热能
C NaOH溶液的浓度约为1.2mol/L
D 该实验表明有水生成的反应都是放热反应.
查看习题详情和答案>>

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):
NaOH(aq)+HCl (aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol
NaOH(aq)+HCl (aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol
.(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,数据如下表所示:
①请填写下表中的空白:
| 温度 | 起始温度t1/℃ | 终止温度 t1/℃ |
温度差 (t2-t1)t1/℃ | ||
| 实验次数 | H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
-53.5kJ/mol
-53.5kJ/mol
kJ/mol(取小数点后一位).③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是
①②③④
①②③④
(填字母).①室温低于10℃时进行实验,②在量取NaOH溶液的体积时仰视读数,③分多次把NaOH溶液倒入盛有硫酸的小烧杯中,④实验时用环形铜丝搅拌棒代替环形玻璃搅拌棒.
(3)将V1mL 0.4mol/L H2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL).下列叙述正确的是
BC
BC
A 做该实验时环境温度为22℃
B 该实验表明化学能可转化为热能
C NaOH溶液的浓度约为1.2mol/L
D 该实验表明有水生成的反应都是放热反应.
(9分)在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 | 质量(g) | 摩尔质量(g ·mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.25 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.25 | 158 |
| 硝酸银 | 0.02 | 170 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为_______ mol/L。(注意:只要求用原始数据写表达式,不需要化简与计算)
(3)配制上述“鲜花保鲜剂”所需的仪器有:烧杯、电子天平、药匙、________________、______________、_______________。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是___________。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理 查看习题详情和答案>>
(9分)(1)已知25℃、101kPa时,一些物质的燃烧热为:
| 化学式 | CO(g) | H2(g) | CH3OH(l) |
| ΔH/( kJ·mol-1) | -283.0 | -285.8 | -726.5 |
请回答下列问题:①该条件下CH3OH(l)完全燃烧的热化学方程式为:__________________________。
②根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)===CH3OH(l)ΔH=____________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1
② CH3OH(g)+O2(g)=CO2(g)+2H2(g) △H2
已知H2(g)+ O2(g)===H2O(g) △H = -241.8 kJ·mol-1
则反应②的△H2 = kJ·mol-1。
(3)甲醇燃料电池的结构示意图如下。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
查看习题详情和答案>>