网址:http://m.1010jiajiao.com/timu3_id_384377[举报]
(12分)纯净物根据其组成和性质可进行如下分类:
(1)上图所示的分类方法属于 (填序号)
A.交叉分类法 B.树状分类法
(2)以H、O、S、N、Na五种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填写于下表相应类别中:
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 |
|
|
|
|
(3)从上表酸及碱中各选出一种能相互反应的物质,并写出其反应的化学方程式:_______________________________________________________。
查看习题详情和答案>>
(12分)纯净物根据其组成和性质可进行如下分类: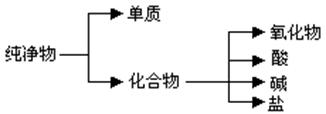
(1)上图所示的分类方法属于 
 (填序号)
(填序号)
A.交叉分类法 B.树状分类法
(2)以H、O、S、N、Na五种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填写于下表相应类别中:
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | | | | |
(12分)纯净物根据其组成和性质可进行如下分类:
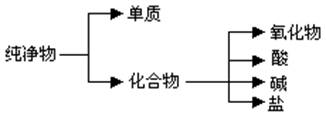
(1)上图所示的分类方法属于 (填序号)
A.交叉分类法 B.树状分类法
(2)以H、O、S、N、Na五种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填写于下表相应类别中:
|
物质类别 |
酸 |
碱 |
盐 |
氧化物 |
|
化学式 |
|
|
|
|
(3)从上表酸及碱中各选出一种能相互反应的物质,并写出其反应的化学方程式:_______________________________________________________。
查看习题详情和答案>>
(12分) NO的生物活性已引起科学家高度重视。它与超氧离子(O2― )反应,该反应的产物本题用A为代号。在生理pH值条件下,A的半衰期为1-2秒。A被认为是人生病,如炎症、中风、心脏病和风湿病等引起大量细胞和组织毁坏的原因。A在巨噬细胞里受控生成却是巨噬细胞能够杀死癌细胞和入侵的微生物的重要原因。科学家用生物拟态法探究了A的基本性质,如它与硝酸根的异构化反应等。他们发现,当16O标记的A在18O标记的水中异构化得到的硝酸根有11% 18O,可见该反应历程复杂。回答如下问题:(1)写出A的化学式。写出NO跟超氧离子的反应。这你认为A离子的可能结构是什么?试写出它的路易斯结构式(即用短横表示化学键和用小黑点表示未成键电子的结构式)。(2)A离子和水中的CO2迅速一对一地结合。试写出这种物种可能的路易斯结构式。(3)含Cu+离子的酶的活化中心,亚硝酸根转化为一氧化氮。写出Cu+和NO2在水溶液中的反应。(4)在常温下把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50oC,发现气体的压力迅速下降,压力降至略小于原压力的2/3就不再改变,已知其中一种产物是N2O,写出化学方程式。并解释为什么最后的气体总压力略小于原压力的2/3。
查看习题详情和答案>>