摘要:14.电离常数等常数是标示.判断物质性质的重要常数.下列关于这些常数的运用错误的是( ) A.Ka(HCN)<Ka(CH3COOH) .说明相同浓度的氢氰酸的酸性比相同浓度的醋酸溶液的酸性弱 B.CH3COONH4溶液近似为中性.说明Ka(CH3COOH)与Kb(NH3·H2O)近似相等 C.Ksp.由此可判断AgCl(s)+I-=AgI(s)+Cl-反应能够进行 D.Ksp2)<Ksp.则可以推断AgCl不溶于稀硝酸.Cu(OH)2也不溶于稀硝酸
网址:http://m.1010jiajiao.com/timu3_id_384371[举报]
化学平衡常数(K)、电离常数( Ka)、溶度积常数(Ksp)是判断物质性质或变化的重要的常数。下列关于这些常数的说法中,正确的是
[ ]
A.化学平衡常数的大小与温度、浓度、压强、催化剂有关
B.当温度升高时,弱酸的电离常数Ka变小
C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-= AgI(s) +Cl-能够发生
D.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸强
查看习题详情和答案>>
B.当温度升高时,弱酸的电离常数Ka变小
C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-= AgI(s) +Cl-能够发生
D.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸强
化学平衡常数(K)、电离常数(Ka)、溶度积常数(KSP)是判断物质性质或变化的重要的常数。下列关于这些常数的说法中,正确的是
A.化学平衡常数的大小与温度、浓度、压强、催化剂有关
B.当温度升高时,弱酸的电离常数Ka变小
C.KSP(AgCl)>KSP(AgI)由此可以判断![]() 能够发生
能够发生
D.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸强
查看习题详情和答案>>(2011?青岛模拟)已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10.现向1L 0.2mol?L-1HF溶液中加入1L 0.2mol?L-1CaCl2溶液,则下列说法中,正确的是( )
查看习题详情和答案>>
(1)如图1,横坐标为溶液的pH,纵标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol?L-1时,可认为沉淀完全).试回答下列问题:

①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol?L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为
②从图1中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=
(2)25℃时,测得浓度为0.1mol?L-1的HA溶液的pH=3,则HA的电离常数Ka=
(3)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如2图所示(实线).图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6mol.
①下列时间段平均反应速率最大的是 ,最小的是 .
A.0-1min B.1-3min C.3-8min D.8-11min
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图2中虚线所示,曲线Ⅰ对应的实验改变的条件是 ,曲线Ⅱ对应的实验改变的条件是 .
③根据该反应特点,此反应自发进行的条件是 (填“高温”、“低温”或“任何温度”).
(4)铁是一种廉价的金属,除了做为重要的结构材料外,现又有了新的用途,磷酸聚合物铁锂电池以其廉价、高容量和安全性逐渐占据市场.高铁电池的研究也在进行中.下图是高铁电池的实验装置:
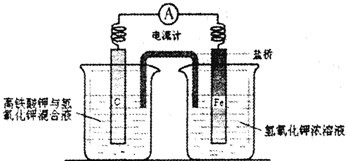
已知放电后,两极反应均生成Fe的+3价的化合物.
①该电池放电时正极发生的电极反应是 .
②若该电池属于二次电池,则充电时阴极反应的电极反应式为 .
查看习题详情和答案>>

①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol?L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为
②从图1中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=
(2)25℃时,测得浓度为0.1mol?L-1的HA溶液的pH=3,则HA的电离常数Ka=
(3)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如2图所示(实线).图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6mol.
①下列时间段平均反应速率最大的是
A.0-1min B.1-3min C.3-8min D.8-11min
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图2中虚线所示,曲线Ⅰ对应的实验改变的条件是
③根据该反应特点,此反应自发进行的条件是
(4)铁是一种廉价的金属,除了做为重要的结构材料外,现又有了新的用途,磷酸聚合物铁锂电池以其廉价、高容量和安全性逐渐占据市场.高铁电池的研究也在进行中.下图是高铁电池的实验装置:

已知放电后,两极反应均生成Fe的+3价的化合物.
①该电池放电时正极发生的电极反应是
②若该电池属于二次电池,则充电时阴极反应的电极反应式为