网址:http://m.1010jiajiao.com/timu3_id_384285[举报]
(1)用分析天平准确称取该样品5.000g,全部溶于水配制成1000.0mL的溶液.用
(2)用浓度为0.1000mol/L的盐酸标准溶液进行滴定.滴定管在使用前应先检漏、洗涤、
(3)若用测定溶液pH的方法来确定滴定的终点,则应用
(4)滴定过程中,锥形瓶中溶液的pH变化如下
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
(5)下表是几种酸碱指示剂的变色范围,根据你作出的中和滴定曲线分析,上述中和滴定中可选用的指示剂是
| 指示剂 | 变色范围 (pH) |
各范围内颜色 | ||
| 前 | 中间 | 后 | ||
| 甲基橙 | 3.1~4.4 | 红 | 橙色 | 黄 |
| 石蕊 | 5.0~8.0 | 红 | 紫色 | 蓝 |
| 酚酞 | 8.2~10.0 | 无 | 粉红 | 红 |
(06年上海化学26)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如下图装置。倾斜A使稀硫酸(足量)与固体 M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为V mL(已折算成标准状况)由上述实验事实可知:?
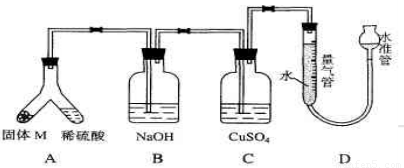
(1)①固体M中一定有的物质是_____(填化学式)理由是_____。②其中一种物质的质量可以确定为____g(用代数式表示)。?
(2)B装置的名称是_____。写出B装置中反应的离子方程式_____。?
(3)C装置的作用是_____,如果实验中没有B装置,则C装置中产生的现象是__________ 。?
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____ 。?
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是__________
a.M中有未反应的铁和硫?
b.测定气体体积时水准管的水面高于量气管的水面?
c.A中留有反应生成的气体?
d.气体进入D装置前未用浓硫酸干燥
查看习题详情和答案>>
(04年上海卷)某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是
(2)如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是 ②在下面的化学式上标出电子转移的方向和数目
KMnO4 + KI + H2SO4 →
(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是
。
查看习题详情和答案>>单质 | A | B | C | D | E | F | G | H | I | J |
熔点(℃) | -150 | 550 | 160 | 210 | -50 | 370 | 450 | 300 | 260 | 250 |
与水反应 |
| √ |
|
|
| √ | √ | √ |
|
|
与酸反应 |
| √ |
| √ |
| √ | √ | √ |
| √ |
与氧气 反应 |
| √ | √ | √ |
| √ | √ | √ | √ | √ |
不发生 化学反应 | √ |
|
|
| √ |
|
|
|
|
|
相对于A元素的原子质量 | 1.0 | 8.0 | 15.6 | 17.1 | 23.8 | 31.8 | 20.0 | 29.6 | 3.9 | 18.0 |
按照元素性质的周期递变规律,试确定以上十种元素的相对位置,并填入下表:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| A |
|
|
|
|
|
| B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|