网址:http://m.1010jiajiao.com/timu3_id_384110[举报]
(共12分)实验室里通常用MnO2与浓盐酸在加热的条件下反应制取氯气,为进行有关氯气的性质实验,需要4瓶容积为100ml的氯气(标准状况)。
(1)写出实验室制取氯气的化学反应方程式并标出电子转移的方向及数目。
(2)制取4瓶氯气,理论上需要MnO2固体的质量是多少?(浓盐酸过量,并可以补充)
(3)实际称量的MnO2固体的质量必需多于理论量,主要原因是什么?
查看习题详情和答案>>
(共12分)实验室里通常用MnO2与浓盐酸在加热的条件下反应制取氯气,为进行有关氯气的性质实验,需要4瓶容积为100ml的氯气(标准状况)。
(1)写出实验室制取氯气的化学反应方程式并标出电子转移的方向及数目。
(2)制取4瓶氯气,理论上需要MnO2固体的质量是多少?(浓盐酸过量,并可以补充)
(3)实际称量的MnO2固体的质量必需多于理论量,主要原因是什么?
(共10分)
市售乙醛通常为40%左右的乙醛溶液。久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液。据测定,上层物质为乙醛的加合物作(C2H4O)n,它的沸点比水的沸点高,分子中无醛基。乙醛在溶液中易被氧化。为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:
(1)(1.5分)先把混合物分离得到(C2H4O)n;将混合物放入分液漏斗,分层清晰后,分离操作是_____________。
(2) (1.5分)证明是否已有部分乙醛被氧化的实验操作和现象是_______。
(3) (2分)若将少量乙醛溶液滴入浓硫酸中,生成黑色物质。请用化学方程式表示这一过程: . 。
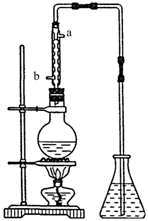 (4) (4分)提取乙醛的装置如下图;烧瓶中放的是(C2H4O)n和6mol/L H2SO4的混合液,锥形瓶中放蒸馏水。加热至混合液沸腾,(C2H4O)n缓慢分解,生成的气体导入锥形瓶的水中。
(4) (4分)提取乙醛的装置如下图;烧瓶中放的是(C2H4O)n和6mol/L H2SO4的混合液,锥形瓶中放蒸馏水。加热至混合液沸腾,(C2H4O)n缓慢分解,生成的气体导入锥形瓶的水中。
① 用冷凝管的目的是 ,冷凝水的进口是 。(填“a”或“b”)。
② 锥形瓶内导管口出现的气泡从下上升到液面的过程中,体积越来越小,直至完全消失,这现象说明乙醇的何种物理性质?
当观察到导管中的气流几小时。必要的操作是:
③ 若n=3,则(C2H4O)n的结构简式是 :
查看习题详情和答案>>水滑石化学式为:[Mg6Al2(OH)16CO3]·4H2O(相对分子质量为602),是环保型阻燃剂。它受热时生成4种不同的氧化物,请写出该物质分解的化学方程式: 。
在医药上,水滑石还能作为抗酸药,作用于胃和十二指肠溃疡等,某研究型学习小组要测定一种市售的水滑石药片中水滑石的质量分数。
【查阅资料】水滑石与稀硫酸反应的化学方程式为:
[Mg6Al2(OH)16CO3]·4H2O+9H2SO4==6MgSO4+Al2(SO4)3+CO2↑+21H2O。药片中除了水滑石外含有一定量的辅料——淀粉等物质。
【提出猜想】小华想将该药片放在空气中充分灼烧完成测定;小明想通过水滑石与硫酸反应原理来完成测定,请你参与探究。
【设计方案】他们设计了不同的实验方案。
小华的方案,称取10.0g市售的水滑石药片研磨成粉末置于通风橱中,充分灼烧至质量不再减少,再称量剩余固体的质量为6.1g,减少的质量即为二氧化碳和水的总质量,则可求的水滑石药片中水滑石的质量分数为 %。
小明的方案:
(1)小明设计了下图所示的实验装置。取10.0g市售的水滑石药片研磨成粉末,进行实验。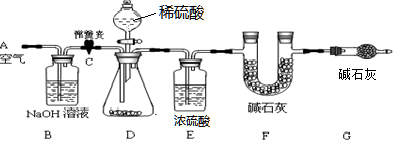
【说明】碱石灰是氧化钙和氢氧化钠固体的混合物。B装置中发生的化学方程式为 。
(2)操作步骤
①连接好装置,检查装置的气密性②打开弹簧夹C,在A处缓缓通入一段时间的空气③称量F的质量④关闭弹簧夹C,慢慢滴加稀盐酸至过量,直至D中无气泡冒出⑤打开弹簧夹C,再次缓缓通入一段时间空气⑥再次称量F的质量,得前后两次质量差为0.44g。
(3)问题探究
B、E装置的作用分别是 、 。若没有G装置,则测定的水滑石的质量分数会 (填“偏大”、“偏小”、“不变”)。实验选用稀硫酸而不选用稀盐酸的理由是 。
(4)数据计算
根据实验数据,可求得水滑石药片中水滑石的质量分数为 %。(写出计算过程)
【方案评价】在上述实验方案中,你认为合理的实验方案是 (填小华或小明),另一个方案不合理的原因是 。
水滑石化学式为:[Mg6Al2(OH)16CO3]·4H2O(相对分子质量为602),是环保型阻燃剂。它受热时生成4种不同的氧化物,请写出该物质分解的化学方程式: 。
在医药上,水滑石还能作为抗酸药,作用于胃和十二指肠溃疡等,某研究型学习小组要测定一种市售的水滑石药片中水滑石的质量分数。
【查阅资料】水滑石与稀硫酸反应的化学方程式为:
[Mg6Al2(OH)16CO3]·4H2O+9H2SO4==6MgSO4+Al2(SO4)3+CO2↑+21H2O。药片中除了水滑石外含有一定量的辅料——淀粉等物质。
【提出猜想】小华想将该药片放在空气中充分灼烧完成测定;小明想通过水滑石与硫酸反应原理来完成测定,请你参与探究。
【设计方案】他们设计了不同的实验方案。
小华的方案,称取10.0g市售的水滑石药片研磨成粉末置于通风橱中,充分灼烧至质量不再减少,再称量剩余固体的质量为6.1g,减少的质量即为二氧化碳和水的总质量,则可求的水滑石药片中水滑石的质量分数为 %。
小明的方案:
(1)小明设计了下图所示的实验装置。取10.0g市售的水滑石药片研磨成粉末,进行实验。
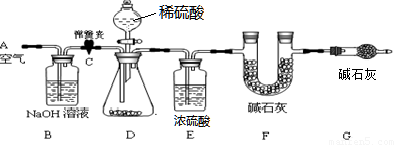
【说明】碱石灰是氧化钙和氢氧化钠固体的混合物。B装置中发生的化学方程式为 。
(2)操作步骤
①连接好装置,检查装置的气密性②打开弹簧夹C,在A处缓缓通入一段时间的空气③称量F的质量④关闭弹簧夹C,慢慢滴加稀盐酸至过量,直至D中无气泡冒出⑤打开弹簧夹C,再次缓缓通入一段时间空气⑥再次称量F的质量,得前后两次质量差为0.44g。
(3)问题探究
B、E装置的作用分别是 、 。若没有G装置,则测定的水滑石的质量分数会 (填“偏大”、“偏小”、“不变”)。实验选用稀硫酸而不选用稀盐酸的理由是 。
(4)数据计算
根据实验数据,可求得水滑石药片中水滑石的质量分数为 %。(写出计算过程)
【方案评价】在上述实验方案中,你认为合理的实验方案是 (填小华或小明),另一个方案不合理的原因是 。
查看习题详情和答案>>