网址:http://m.1010jiajiao.com/timu3_id_383872[举报]
| 运用化学反应原理可以更好的分析化学反应的本质 。 (1)下列四组物质反应,其中与其它三组有本质不同的是_______。 A.Na2O2 + H2O B.F2 + H2O C.Cl2 + H2O D.NO2 + H2O (2)在 25℃下,向浓度均为 0.1mol·L-1 的NaCl和KBr混合溶液中逐滴加入硝酸银溶液,先生成_______沉淀 ( 填化学式 );当两种沉淀共存时溶液中 (3) 汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)  N2(g)+2CO2(g) 该反应混合体系中NO 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: N2(g)+2CO2(g) 该反应混合体系中NO 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: | ||||||||
 | ||||||||
① 2NO(g)+2CO(g) N2(g)+2CO2(g) 的△H _____0( 填 “>” 或 “<”) N2(g)+2CO2(g) 的△H _____0( 填 “>” 或 “<”) ②若温度为Tl 、T2, 反应的平衡常数分别为 Kl、K2, 则K1_____K2;若反应进行到状态D 时,V正___V逆(填“>”、“<”或“=”) ③在恒容的密闭容器中,该反应达平衡后,改变某一条件,下列示意图不正确的是 | ||||||||
 | ||||||||
| (4)分析下表提供的数据: | ||||||||
| ||||||||
| ① 84 消毒液 ( 有效成分为 NaClO) 久置于空气中会失效,写出发生反应的离子方程式:____________; __________________。 ②判断在等浓度的 NaClO、NaHCO3混合溶液中,各种离子浓度由大到小的顺序:_________________。 |
I.已知:反应①H2(g) + Cl2(g) = 2HCl(g) ΔH= —184 kJ/mol
②4HCl(g)+O2(g)
 2Cl2(g)+2H2O(g)
ΔH= —115.6 kJ/mol
2Cl2(g)+2H2O(g)
ΔH= —115.6 kJ/mol


请回答:
(1)H2与O2反应生成气态水的热化学方程式
(2)断开1 mol H—O 键所需能量约为 kJ。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:  ,它所对应的化学方程式为:
。
,它所对应的化学方程式为:
。
(2)已知在400℃时,N2 (g)+ 3H2(g)  2NH3(g)
△H<0 的K=0.5, 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
2NH3(g)
△H<0 的K=0.5, 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g) + 3B(g)  2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
|
t/K |
300 |
400 |
500 |
… |
|
K/(mol·L-1)2 |
4×106 |
8×107 |
K1 |
… |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)。
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
查看习题详情和答案>>
I.已知:反应H2(g) + Cl2(g) = 2HCl(g) ΔH= —184 kJ/mol
4HCl(g)+O2(g)  2Cl2(g)+2H2O(g)
ΔH= —115.6 kJ/mol
2Cl2(g)+2H2O(g)
ΔH= —115.6 kJ/mol


请回答:
(1)H2与O2反应生成气态水的热化学方程式
(2)断开1 mol H—O 键所需能量约为 kJ
II.试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: ,它所对应的化学方程式为:
,它所对应的化学方程式为:
(2)已知在400℃时,N2 (g)+ 3H2(g)
 2NH3(g)
△H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正 v(N2)逆(填:>、<、=、不能确定)(1分)
2NH3(g)
△H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正 v(N2)逆(填:>、<、=、不能确定)(1分)
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)(1分)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g) + 3B(g)  2C(g)
+ D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
2C(g)
+ D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
|
t/K |
300 |
400 |
500 |
… |
|
K/(mol·L—1)2 |
4×106 |
8×107 |
K1 |
… |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”) (1分)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。

①放电时,负极的电极反应式为
②假设装置中盛装100.0 mL 3.0 mol·L—1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系为
查看习题详情和答案>>
I.已知:反应




请回答:
 反应生成气态水的热化学方程式__________________________
反应生成气态水的热化学方程式__________________________
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:
它所对应的化学方程式为:_________________________________________________
(2)已知在400℃时,反应

 =0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应
=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应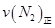 ____________
____________ (填:>、<、=、不能确定);
(填:>、<、=、不能确定);
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积分数增加,
可采取的正确措施是____________(填序号)
A.加催化剂 B.升高温度 C.缩小体积增大压强 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:

 ,其化学平衡常数K与温度T的关系如下表:
,其化学平衡常数K与温度T的关系如下表:

请完成下列问题:
①判断该反应的 ___________0(填“>”或“<”)
___________0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是___________(填序号)。
A. B.容器内压强保持不变
B.容器内压强保持不变
C.A和B的转化率相等 D.混合气体的密度保持不变
查看习题详情和答案>>