网址:http://m.1010jiajiao.com/timu3_id_383756[举报]
某化学兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质。
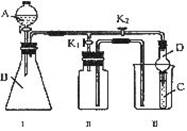
(1)能用Ⅰ装置制取,用Ⅱ装置收集的气体(K2关闭,K1打开)(写出一种即可) ;有关化学反应方程式为: 。
能用Ⅰ装置制取,不能用Ⅱ装置收集的气体(K2关闭,K1打开)(写出一种即可) ;若收集该气体,需对Ⅱ进行怎样的改进? 。
(2)利用Ⅰ、Ⅲ装置验证物质的性质(K2打开,K1关闭)。
已知浓![]() 与次氯酸钙能反应:
与次氯酸钙能反应:![]() 。甲同学想证明氧化性:
。甲同学想证明氧化性:![]() ,则在A中加浓盐酸,B中加
,则在A中加浓盐酸,B中加![]() ,C中加 ,观察到C中的现象是 ;
,C中加 ,观察到C中的现象是 ;
从环境保护的观点考虑,此装置有何不足? ,应怎样改进? ;
画出实验室中通常进行此操作的装置图: 。
乙同学利用此装置制取乙炔气体,将其通入C中验证性质。若C中装有酸性![]() 溶液,其现象为 ;若C中装有溴水,则乙炔与溴水反应的产物为(写结构简式) 。
溶液,其现象为 ;若C中装有溴水,则乙炔与溴水反应的产物为(写结构简式) 。
某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体又可用于验证物质的性质。请回答下列问题:
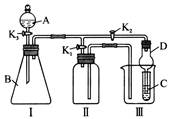
(1)利用装置Ⅰ制取气体,生成气体的反应应具备的条件是 。
(2)利用装置Ⅰ、Ⅱ制取气体(K2关闭,K1打开)。甲同学认为:利用装置Ⅱ可以收集H2、NH3等气体,但不能收集O2和NO等气体,其理由是:
_______________________________________________________________________;
乙同学认为:对装置Ⅱ做简易改进(不改变仪器装置),也可收集O2和NO等气体,但不能收集NO2气体,改进的方法是 ;不能收集NO2气体的原因是(用化学方程式表示) ;
(3)利用装置Ⅰ、Ⅲ 验证物质的性质(K2打开,K1关闭)。如要设计实验证明氧化性
KMnO4>Cl2>Br2,则可在A 中加浓盐酸,B中加 ,C中加 ,观察到C中的现象是 。
查看习题详情和答案>>
某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体又可用于验证物质的性质。请回答下列问题:
(1)利用装置Ⅰ制取气体,生成气体的反应应具备的条件是 。
(2)利用装置Ⅰ、Ⅱ制取气体(K2关闭,K1打开)。甲同学认为:利用装置Ⅱ可以收集H2、NH3等气体,但不能收集O2和NO等气体,其理由是:
_______________________________________________________________________;
乙同学认为:对装置Ⅱ做简易改进(不改变仪器装置),也可收集O2和NO等气体,但不能收集NO2气体,改进的方法是 ;不能收集NO2气体的原因是(用化学方程式表示) ;
(3)利用装置Ⅰ、Ⅲ 验证物质的性质(K2打开,K1关闭)。如要设计实验证明氧化性
KMnO4>Cl2>Br2,则可在A 中加浓盐酸,B中加 ,C中加 ,观察到C中的现象是 。

(1)利用装置Ⅰ制取气体,生成气体的反应应具备的条件是 。
(2)利用装置Ⅰ、Ⅱ制取气体(K2关闭,K1打开)。甲同学认为:利用装置Ⅱ可以收集H2、NH3等气体,但不能收集O2和NO等气体,其理由是:
_______________________________________________________________________;
乙同学认为:对装置Ⅱ做简易改进(不改变仪器装置),也可收集O2和NO等气体,但不能收集NO2气体,改进的方法是 ;不能收集NO2气体的原因是(用化学方程式表示) ;
(3)利用装置Ⅰ、Ⅲ 验证物质的性质(K2打开,K1关闭)。如要设计实验证明氧化性
KMnO4>Cl2>Br2,则可在A 中加浓盐酸,B中加 ,C中加 ,观察到C中的现象是 。
(14分)某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。
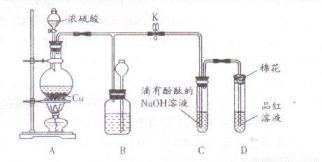
(1)装置D中试管口放置的棉花中应浸一种液体,这种液体是 ,其作用是 。
(2)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是 。B中应放置的液体是 (填字母)。
a.水 b.酸性KMnO4 c.浓溴水 d.饱和NaHSO3
(3)取6.4g铜片和12mL 18.4mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余。某同学根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是
②下列药品能用来证明反应结束后烧瓶中确实有余酸的是 (填字母)。
a.铁粉 b.银粉 c.碳酸氢钠溶液 d.氯化钡溶液
(4)为定量测定余酸物质的量浓度,某同学进行了如下设计:先测定铜片和浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度。测定SO2的量的方案很多,下列方案可行的是
(填字母)
a.将装置中产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
b.将装置中产生的气体缓缓通入足量氢氧化钡溶液中,反应完全后过滤、洗涤、干燥、称量沉淀
c.将装置中产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液中,反应完全后过滤,洗涤干燥、称量沉淀
查看习题详情和答案>>